

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
分析 硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣主要为SiO2、H2SiO3,滤液A在含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液PH=4使铁离子全部沉淀,此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体;
(1)根据氢氧化物开始沉淀和完全沉淀的pH列表进行分析PH=4完全沉淀、不完全沉淀的离子,依据离子沉淀的PH值分析,铁离子全部沉淀PH=3.7,铝离子全部沉淀PH=5.2,铜离子开始沉淀PH=4.2,铝离子全部沉淀,铜离子液有沉淀,调节溶液pH不能使杂质完全除去而不损失Cu2+;
(2)上述分析可知加入试剂A为氧化亚铁离子为铁离子的氧化剂且不能引入锌的杂质,所以需要加入过氧化氢,双氧水酸性溶液中将亚铁离子氧化成铁离子;
(3)根据滤液A显示酸性,加入的试剂不能引进新的杂质进行分析;
(4)滤液得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(5)①测得的产品纯度偏高,可能是样品失去结晶水导致样品质量减小,或混入的硫酸根离子和加入的氯化钡生成更多的硫酸钡;
②取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,结晶水的质量为ag-bg;依据物质的量之比计算n值.
解答 解:(1)步骤中,调节pH=4时,所得滤渣B的成分依据表中数据可知,pH=4时,三价铁离子完全生成了氢氧化铁沉淀,而铝离子完全沉淀需要的PH是5.2,所以铝离子没有完全沉淀,铝离子有少量沉淀,所以渣B的成分为:Fe(OH)3、Al(OH)3 ,依据离子沉淀的PH值分析,铁离子全部沉淀PH=3.7,铝离子全部沉淀PH=5.2,铜离子开始沉淀PH=4.2,铝离子全部沉淀,铜离子液有沉淀,调节溶液pH不能使杂质完全除去而不损失Cu2+,
故答案为:Fe(OH)3、Al(OH)3 ;否,铝离子全部沉淀时铜离子有沉淀;
(2)上述分析可知加入试剂A为氧化亚铁离子为铁离子的氧化剂且不能引入锌的杂质,所以需要加入过氧化氢,双氧水酸性溶液中将亚铁离子氧化成铁离子,双氧水将亚铁离子氧化成铁离子的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)由于滤液A显示酸性,加入的试剂能够中和溶液中的氢离子,还不能引进新的杂质,所以应该选用氧化铜,碱式碳酸铜,氢氧化铜,等,故选BC,
故答案为:bd.
(4)滤液B为硫酸铜溶液,通过蒸发浓缩、冷却结晶,过滤洗涤等操作可得到硫酸铜晶体;
故答案为:冷却结晶;
(5)①测得的产品纯度偏高,可能是样品失去结晶水导致样品质量减小,或混入的硫酸根离子和加入的氯化钡生成更多的硫酸钡,
a.产品失去部分结晶水导致样品质量减小,使测得的产品纯度偏高,故a正确;
b.产品中混有CuCl2•2H2O对测定纯度无影响,故b错误;
c.产品中混有Al2(SO4)3•12H2O,溶解后生成硫酸钡沉淀质量增大,故c正确;
d.产品中混有Na2SO4,溶解后生成硫酸钡沉淀质量增大,故d正确
故选acd;
②取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,结晶水的质量为ag-bg;依据物质的量之比计算n值,1:n=$\frac{bg}{160g/mol}$:$\frac{ag-bg}{18g/mol}$,计算得到n=$\frac{80(a-b)}{9b}$,
故答案为:$\frac{80(a-b)}{9b}$.
点评 本题为工艺流程题,考查了方程式的书写、物质分离的方法、有关方程式的计算,主要是铝及其化合物性质的分析应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH4和 C3H4,体积比为 1:1 | B. | C2H2和 C2H6,体积比为 3:1 | ||
| C. | C2H4和C2H6,体积比为 2:1 | D. | C2H2和 C2H4,体积比为 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花、羊毛、木材和草类的纤维都是天然纤维,人造毛、人造丝是合成纤维 | |
| B. | 哥本哈根会议重点讨论了地球环境问题,其中破坏臭氧层的氟氯代烷是一类多卤代烃,主要含氟和氯的烷烃衍生物,有的还含有溴原子 | |
| C. | 煤的干馏产物有焦炭、煤焦油、焦炉气、粗氨水和粗苯等 | |
| D. | 肥皂和合成洗涤剂的去污原理相似,固态的合成洗涤剂就是洗衣粉,加入蛋白酶可以提高对血迹、奶迹等蛋白质污物的去污能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
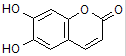
| A. | M的相对分子质量是180 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com