
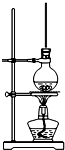
 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
分析 (1)乙醇和乙酸在浓H2SO4做催化剂的条件下生成乙酸乙酯,酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)长导管起导气,平衡气压,冷凝蒸气的作用;沸点低的液体加热要加碎瓷片,防止暴沸;
(3)反应物浓度越大,反应速率越快,随着反应的进行,反应物的浓度在逐渐减小;
(4)根据n=$\frac{m}{M}$、v=$\frac{n}{△t}$计算;
(5)转化率=$\frac{已经转化的物质的量}{原开始的物质的量}$×100%,欲提高乙酸的转化率,需平衡正向移动,可分离出乙酸乙酯或增加乙醇的量.
解答 解:(1)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为C2H5OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:C2H5OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)乙酸和乙醇易挥发,装置中长导管的主要作用是:长导管起导气,平衡气压,冷凝蒸气的作用,液体乙酸乙醇沸点低,加入沸石(碎瓷片),可以通过沸石(碎瓷片)孔隙凝聚蒸汽,使成为气泡浮出,防止暴沸,
故答案为:平衡气压,冷凝回流;沸石或碎瓷片;防止暴沸;
(3)前20min开始反应物浓度大,反应速率快,以后每20min,反应物浓度降低,反应速率减慢,生成酯的厚度不及前20min,
故答案为:开始反应物浓度大,反应速率快;
(4)若每1mm酯的质量均为0.088g,则前40min内酯的厚度为6×0.088g,乙酸乙酯的物质的量为n=$\frac{6×0.088g}{88g/mol}$=6×10-3 mol,
v=$\frac{n}{△t}$=$\frac{6×1{0}^{-3}mol}{40min}$=0.00015 mol/min,
故答案为:0.00015;
(5)将15mL无水酒精放入容器进行反应,乙醇(密度0.78g/mL)开始乙醇的物质的量为n=$\frac{0.78g/mL×15mL}{46g/mol}$,达到平衡时乙酸乙酯的物质的量为n=8×10-3 mol,消耗乙醇为8×10-3 mol,则转化率=$\frac{已经转化的物质的量}{原开始的物质的量}$×100%=$\frac{8{×}^{-3}}{\frac{0.78×15}{46}}$≈31.5%,欲提高乙酸的转化率,需平衡正向移动,可分离出产品或增加反应物的浓度,即分离出乙酸乙酯或增加乙醇的量,
故答案为:31.5;分离出乙酸乙酯或增加乙醇的量.
点评 本题考查乙酸乙酯的制备,题目难度中等,注意掌握乙酸乙酯的制取原理,明确反应过程中浓硫酸、饱和碳酸钠溶液的作用,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | ①和②混合后,酸碱恰好中和,溶液呈中性 | |
| B. | ①和③中均有c(F-)+c(HF)=0.1mol/L | |
| C. | ①和③混合:c(F-)+c(OH-)=c(H+)+c(HF) | |
| D. | 由水电离出来的c(OH-):②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
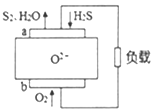
| A. | 电极a是正极 | |
| B. | O2-由电极a移向电极b | |
| C. | 电极 a 的反应式为:2H2S+2O2--4e-═S2+2H2O | |
| D. | 当通入1.12LO2,转移电子数0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1AlCl3 溶液中,含 Al3+数目小于 NA | |
| B. | 标准状况下,6.0gNO 和 2.24LO2混合,所得气体的分子数目为 0.2NA | |
| C. | 25℃,1LpH=1 的稀硫酸中含有的 H+数为 0.2NA | |
| D. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小反应容器的体积 | B. | 增加反应物的物质的量 | ||
| C. | 升高温度 | D. | 增加催化剂的用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
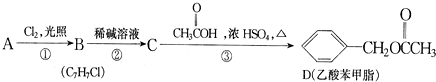
 、
、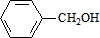 .
.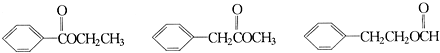
 、
、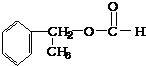 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
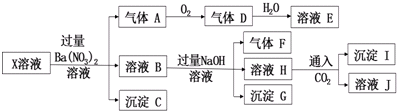
| A. | 气体A是无色有刺激性气味的有毒气体 | |
| B. | X中肯定存在Fe2+、Mg2+、NH4+、SO42- | |
| C. | 沉淀I中加入过量溶液E,沉淀完全溶解 | |
| D. | X中不能确定的阳离子只有A13+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com