
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:

(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
(17分)
(1)(共4分)管壁内有淡黄色固体生成(2分) 稀释浓硫酸,防止硫化氢被氧化(2分)
(2)(共6分)浓氨水、生石灰(或碱石灰、固体NaOH,4分) 保持集气瓶内外气压平衡(1分),以便左右两边产生的气体顺利导入 (1分)
(3)(共7分)①放低(或移动)水准管位置(2分 ),使水准管、量气管内液面相平(2分) ②70.00%(3分)
【解析】
试题分析:(1)依题意,二氧化硫气体与硫化氢气体反应生成单质硫和水,由此推断反应现象为管壁内有淡黄色固体生成、有液滴生成;由于硫化氢能被浓硫酸氧化,则硫化亚铁出加水的目的是稀释浓硫酸,防止稀硫酸与硫化亚铁反应放出的硫化氢气体被浓硫酸氧化;(2)根据二氧化硫的性质推断,右侧Y型管的作用是制取氨气,由于无加热仪器,则选择的试剂为浓氨水液体和生石灰或碱石灰或氢氧化钠固体,产生的氨气溶于BaCl2溶液,得到碱性溶液,再通入二氧化硫气体时,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与BaCl2溶液发生复分解反应,可以得到白色BaSO3沉淀和NH4Cl溶液;导管A的作用是保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入;(3)读数时,应放低(或移动)水准管位置,使水准管中的液面高于量气管中液面相平,以免造成误差;防止倒吸;设铁镁合金含有xmolFe、ymolMg,根据m=n•M,则①56x+24y=0.080;由于Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑中的系数之比等于物质的量之比,充分反应后得到氢气的物质的量为(x+y)mol;由于初末读数相差(45.80—1.00)mL=(45.80—1.00)×10—3L,说明充分反应后得到氢气的体积为(45.80—1.00)×10—3L;由于n=V/Vm,根据氢气的物质的量相等可得:②x+y
=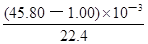 ;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为
;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为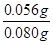 ×100%=70%。
×100%=70%。
考点:考查综合实验和化学计算,涉及实验现象的描述、解释原因、制取氨气的试剂、解释目的、量气方法、物质的量在化学方程式计算中的应用、摩尔质量、气体摩尔体积、质量分数等。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
| (1) | 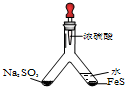 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为 |
| (2) | 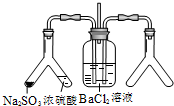 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以迅速产生白色沉淀.则右侧Y型管中应放置的药品是 |
| (3) | 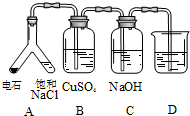 |
实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: CaC2+2H2O→Ca(OH)2+CH≡CH ②B装置中出现黑色沉淀,可判断电石气中含有H2S ③为验证电石气的主要成分,D中盛放 |
| (4) | 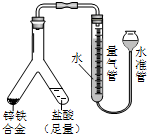 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的质量分数为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
| (1) | | 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
| (2) | | 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
| (3) |
| 实验目的:探究电石气中的成分 ① 装置A中的化学反应方程式为: _________________________________________。 ②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为__________________。 ③为验证电石气的主要成分,D中盛放________。 |
| (4) |
| 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL,则合金中铁的含量为________%(保留2位小数,已折算标况)。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com