
【题目】氨催化分解既可防治氨气污染,又能得到氢能源。回答下列问题:
(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是________________。NH3分解的热化学方程式为________________。
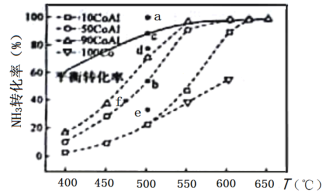
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为________________:升高温度,NH3的平衡转化率增大,其原因是________________;温度一定时,如果增大气体流速,则b点对应的点可能________________(填“a”“c”“d”“e”或“f”)。
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)N2(g)+3H2(g)的平衡常数K=________________mol2·L-2,NH3的分解率为________________,达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________________(填“增大”“不变”或“减小”)。
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中![]() =________________(填标号).
=________________(填标号).
A.始终碱小B.始终增大C.先减小后增大D.先增大后减小
【答案】反应①放出的热量很大 2NH3(g)![]() N2(g)+3H2(g) △H=+92.1kJ/mol 90CoAl NH3分解反应为吸热反应,升高温度,平衡向正反应方向移动 e 7.5 75% 减小 B
N2(g)+3H2(g) △H=+92.1kJ/mol 90CoAl NH3分解反应为吸热反应,升高温度,平衡向正反应方向移动 e 7.5 75% 减小 B
【解析】
(1)根据盖斯定律由![]() ×①-3(②+③)可得到目标热化学方程式;
×①-3(②+③)可得到目标热化学方程式;
(2)根据图像中几种催化剂对反应历程的影响进行分析,由外界条件对平衡移动的影响来分析判断;
(3)根据题中提供的数据列出三段式,计算平衡常数和转化率。
(4)根据二者混合后溶液里离子浓度的变化来分析。
(1)反应①的ΔH1=-1266.6kJ·mol-1,放出的热量很大,故热力学趋势很大;
反应:①4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1) ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1) ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g) ΔH3=+44.0kJ·mol-1
根据盖斯定律,将方程式![]() ×①-3(②+③)得方程式2NH3(g)
×①-3(②+③)得方程式2NH3(g)![]() N2(g)+3H2(g) △H=
N2(g)+3H2(g) △H=![]() (-1266.6 kJ/mol)-3(-285.8+44) kJ/mol=+92.1 kJ/mol;
(-1266.6 kJ/mol)-3(-285.8+44) kJ/mol=+92.1 kJ/mol;
(2)由图分析可知,90CoAl催化剂在较低温度下就达到平衡状态,反应速率最快,反应的活化能最小;由2NH3(g)![]() N2(g)+3H2(g) △H=+92.1kJ/mol可知 NH3分解反应为吸热反应,升高温度平衡向正反应方向移动,NH3的转化率增大;此反应为气体体积增大的反应,温度一定时,增大气体流速平衡逆向移动,氨气转化率减小,b点对应的点可能为e点,答案为:90CoAl;NH3分解反应为吸热反应,升高温度,平衡向正反应方向移动;e;
N2(g)+3H2(g) △H=+92.1kJ/mol可知 NH3分解反应为吸热反应,升高温度平衡向正反应方向移动,NH3的转化率增大;此反应为气体体积增大的反应,温度一定时,增大气体流速平衡逆向移动,氨气转化率减小,b点对应的点可能为e点,答案为:90CoAl;NH3分解反应为吸热反应,升高温度,平衡向正反应方向移动;e;
(3)由题中数据可知,设达到平衡时氮气的物质的量为xmol,列三段式为:
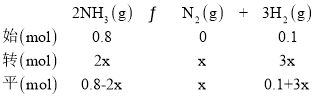
相同条件下气体的物质的量之比等于体积之比,所以达到平衡时N2的体积分数为:![]() =20%,解得x=0.3mol,因为容器体积为1L,气体的物质的量与物质的量浓度数值相等,所以平衡常数K=
=20%,解得x=0.3mol,因为容器体积为1L,气体的物质的量与物质的量浓度数值相等,所以平衡常数K=![]() =7.5,NH3的分解率为
=7.5,NH3的分解率为![]() 100%=75%;达到平衡后再加入0.8molNH3和0.1molH2,相当于增大压强,反应逆向移动,氨气的转化率减小,答案为:7.5;75%;减小;
100%=75%;达到平衡后再加入0.8molNH3和0.1molH2,相当于增大压强,反应逆向移动,氨气的转化率减小,答案为:7.5;75%;减小;
(4)常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液发生反应,CH3COOH电离出的H+消耗NH3·H2O电离出的OH-,c(OH-)减小,促进NH3·H2O的电离,铵根离子浓度增大,一水合氨浓度减小,因此在滴加CH3COOH溶液过程中![]() 比值始终增大,答案为B。
比值始终增大,答案为B。


科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图:
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图:
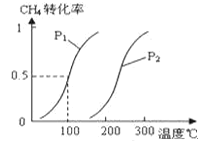
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为______。
②在其它条件不变的情况下升高温度,化学平衡常数将_______(填“增大”“减小”或“不变”)。
③图中的P1_____P2(填“<”、“>”或“=”),100℃时平衡常数为________。
④保持反应体系为100℃,5min后再向容器中充入H2O、H2各0.5mol,化学平衡将向_____移动(填“向左”“向右”或“不”)。
(2)在压强为0.1MPa条件下,将amolCO与3amol H2的混合气体在催化剂作用下能自发发生反应Ⅱ:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H_____0,△S_____0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可以提高CO转化率的是______。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1molCO和3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
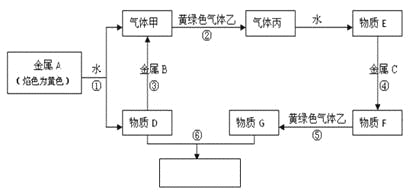
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A、______B、______C、________乙__________
(2)写出下列反应化学方程式:
反应①___________________________________
反应③___________________________________
(3)写出下列反应离子方程式:
反应④___________________________________
反应⑥___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
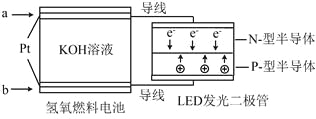
A.a处通入O2
B.b处为电池正极,发生了还原反应
C.通入O2的电极发生反应:O2+4e-+4H+ = 2H2O
D.该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
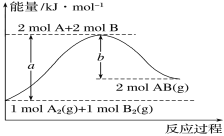
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是____。
(2)倒入NaOH溶液的正确操作是___(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是____。
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=____( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.量取NaOH溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室还可以利用高锰酸钾制氯气,其原理为:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O,若有15.8g KMnO4做氧化剂,试计算参加反应盐酸的物质的量和被氧化的盐酸的质量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A | B | C | D | |
装 置 |
|
|
|
|
目的 | 证明AlCl3是共价化合物 | 证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成 | 证明氯气氧化性强于I2 | 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com