
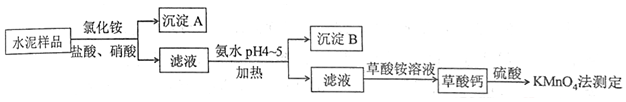
分析 水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物,加入氯化铵、盐酸和硝酸,由于二氧化硅与酸不反应,则得到的沉淀A为SiO2,滤液中含有Fe3+、Al3+、Mg2+等离子,加入氨水调节pH4-5,可生成Al(OH)3、Fe(OH)3沉淀,加热的目的是防止生成胶体而难以分离,滤液主要含有Ca2+,加入草酸铵可生成草酸钙沉淀,加入硫酸用高锰酸钾测定,发生5Ca2+~5H2C2O4~2KMnO4,根据高锰酸钾的量可计算含量,以此解答该题.
解答 解:(1)铁离子在pH较小时易生成沉淀,加入硝酸可氧化亚铁离子生成铁离子,比避免引入新杂质,还可用过氧化氢代替硝酸,
故答案为:将样品中的Fe2+氧化为Fe3+;H2O2;
(2)由以上分析可知沉淀A为SiO2,不溶于强酸但可与一种弱酸反应,应为与HF的反应,方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2;SiO2+4HF=SiF4↑+2H2O;
(3)滴加氨水,溶液呈碱性,此时不用考虑盐类水解的问题,加热的目的是防止生成胶体而难以分离,生成的沉淀主要是Al(OH)3、Fe(OH)3,
故答案为:防止胶体生成,易生成沉淀;Al(OH)3、Fe(OH)3;
(4)反应的关系式为5Ca2+~5H2C2O4~2KMnO4,
n(KMnO4)=0.0500mol/L×36.00mL=1.80mmol,
n(Ca2+)=4.50mmol,
水泥中钙的质量分数为$\frac{4.5×1{0}^{-3}mol×40.0g/mol}{0.400g}$×100%=45.0%,
故答案为:45.0%.
点评 本题为2017年辽宁考题,侧重考查物质的含量的测定,为高频考点,注意把握流程的分析,把握物质的性质,结合关系式法计算,题目有利于培养学生的分析能力、实验能力和计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的或结论 | |
| A | 某钾盐溶于盐酸.产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
| B | 将FeCl2溶液加热蒸发 | 制备FeCl2晶体 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热,得到蓝色溶液 | 蔗糖水解的产物没有还原性 |
| D | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中的少量FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
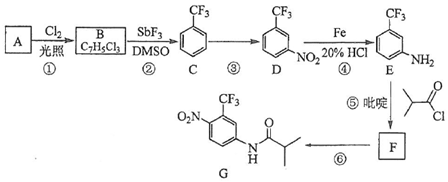
 .C的化学名称是三氟甲苯.
.C的化学名称是三氟甲苯.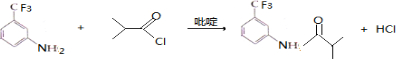 .吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.
.吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.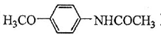 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(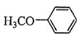 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线 (其他试剂任选).
(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.
.B→C的反应条件为加热(或煅烧),C→Al的制备方法称为电解法.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
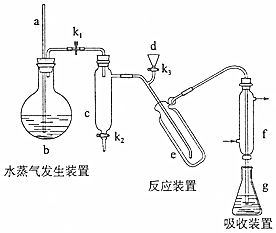
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v生成(CH3OH)=v消耗(CO) | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | CO、H2、CH3OH的浓度比为1:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
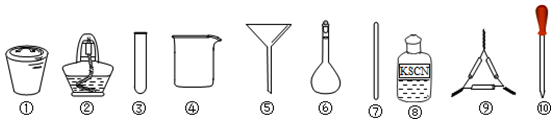
| A. | 将茶叶灼烧灰化,选用①、②、⑦和⑨ | |
| B. | 用浓硝酸溶解茶叶并加蒸馏水稀释,选用③和⑩ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验中滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com