
分析 (1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理书写Cu+的价电子排布式;
(2)①由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
②根据无机苯中氮原子和硼原子都采取sp2杂化分析;
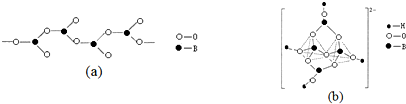
(3)有1个O连着一个B,剩余的两个O分别连着2个B,说明有一个O完全属于B,剩下的两个O,B只占有O的$\frac{1}{2}$;硼砂晶体中阴离子[B4O5(OH)4]2-中一半sp3杂化形成BO4四面体;另一种是sp2杂化形成BO3平面三角形结构;
(4)根据均摊法计算晶胞中B、N原子数目,进而计算晶胞中含有B、N原子总体积,计算晶胞的体积,晶胞的空间利用率=$\frac{晶胞中B、Ni原子总体积}{晶胞体积}$×100%.
解答 解:(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+的价电子排布式3d10 ,原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定,
故答案为:3d10;结构上Cu2+为3d9,而Cu+为3d10全充满更稳定;
(2)①3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,
A.由CH4变为CO2,碳原子杂化类型由sp3转化为sp,反应前后碳原子的轨道杂化类型已经改变,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.B一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确;
故答案为:A;
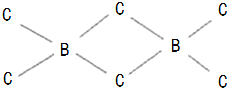
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键.B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个;
故答案为:12;
(3)图(a)是一种链状结构的多硼酸根,从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×$\frac{1}{2}$)=1:2,化学式为:[BO2]nn-(或BO2-),从图(b)是硼砂晶体中阴离子的环状结构可看出,[B4O5(OH)4]2-一半sp3杂化形成两个四配位BO4四面体;另一半是sp2杂化形成两个三配位BO3平面三角形结构,
故答案为:[BO2]nn-(或BO2-);sp2、sp3.
(4)方氮化硼晶胞结构与金刚石类似,晶胞结构图为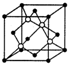 ,B占据立方体的8个顶点和6个面心,所以B原子数目为=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N原子数目=4;B原子半径为bpm,则晶胞中B原子总体积=4×$\frac{4}{3}$×π×(b)3pm3=$\frac{16}{3}$πb3pm3,N原子半径为a pm,则晶胞中N原子总体积=4×$\frac{4}{3}$×π×(a)3pm3=$\frac{16}{3}$πa3cm3,故晶胞中B、N原子总体积=$\frac{16}{3}$πa3cm3+$\frac{16}{3}$πb3cm3=$\frac{16}{3}$π(a3+b3)cm3,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为x,所以$\frac{1}{4}$×($\sqrt{3}$x)=a+b,x=$\frac{4}{\sqrt{3}}$(a+b),晶胞体积=x3=$\frac{64}{3\sqrt{3}}$(a+b)3pm3,所以间利用率=$\frac{\frac{16}{3}π({a}^{3}+{b}^{3})}{\frac{64}{3\sqrt{3}}(a+b)^{3}}$=$\frac{\sqrt{3}π({a}^{3}+{b}^{3})}{4(a+b)^{3}}$;
,B占据立方体的8个顶点和6个面心,所以B原子数目为=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N原子数目=4;B原子半径为bpm,则晶胞中B原子总体积=4×$\frac{4}{3}$×π×(b)3pm3=$\frac{16}{3}$πb3pm3,N原子半径为a pm,则晶胞中N原子总体积=4×$\frac{4}{3}$×π×(a)3pm3=$\frac{16}{3}$πa3cm3,故晶胞中B、N原子总体积=$\frac{16}{3}$πa3cm3+$\frac{16}{3}$πb3cm3=$\frac{16}{3}$π(a3+b3)cm3,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为x,所以$\frac{1}{4}$×($\sqrt{3}$x)=a+b,x=$\frac{4}{\sqrt{3}}$(a+b),晶胞体积=x3=$\frac{64}{3\sqrt{3}}$(a+b)3pm3,所以间利用率=$\frac{\frac{16}{3}π({a}^{3}+{b}^{3})}{\frac{64}{3\sqrt{3}}(a+b)^{3}}$=$\frac{\sqrt{3}π({a}^{3}+{b}^{3})}{4(a+b)^{3}}$;
故答案为:$\frac{\sqrt{3}π({a}^{3}+{b}^{3})}{4(a+b)^{3}}$.
点评 本题是对物质结构知识的综合考查,涉及核外电子排布规律、分子结构与性质、杂化轨道、晶胞计算、空间利用率的计算等,需要学生具有一定的空间想象与数学计算能力,题目难度中等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:填空题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | J | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | NaCl | C. | Na2CO3 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
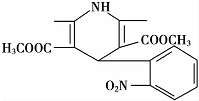
| A. | 该化合物的分子式为C17H17N2O6 | |
| B. | 该化合物的分子中含有三种不同的官能团 | |
| C. | 该化合物能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应 | |
| D. | 该化合物能发生水解反应、聚合反应、取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 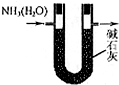 用如图装置干燥氨气 | |
| B. | 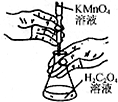 用如图装置进行高锰酸钾溶液滴定草酸溶液实验 | |
| C. | 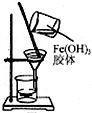 用如图装置可分离氢氧化铁胶体中Fe(OH)3和水 | |
| D. |  用如图装置可验证酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Y的气态氢化物的沸点在同主族中最高,所以其气态氢化物最稳定 | |
| B. | W的氧化物与X、Z形成的化合物中所含化学键相同 | |
| C. | 简单离子半径:W>Z>Y | |
| D. | 单质的氧化性:Y>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com