
| A. | 6 | B. | 7 | C. | 5 | D. | 4 |
分析 ①Si可用于半导体材料;
②工业制玻璃主要原料有石英、纯碱和石灰石;
③Fe2O3为红色固体;
④氧化镁熔点比较高;
⑤NaClO具有强的氧化性;
⑥氨碱法制纯碱以食盐、石灰石、氨气为原料来制取;
⑦SO2有毒;
⑧铝热反应放出大量的热能够熔化钢轨;
⑨NH3具有易液化的性质;
⑩AgI易与空气中水蒸气结合形成晶核.
解答 解:①Si可用于半导体材料,二氧化硅用于光导纤维,故错误;
②工业制玻璃主要原料有石英、纯碱和石灰石,故正确;
③Fe2O3为红色固体,可用于红色涂料,故正确;
④氧化镁熔点比较高,可用于耐火材料,故正确;
⑤NaClO具有强的氧化性,可用于杀菌消毒,故正确;
⑥氨碱法制纯碱的实验原理进行分析,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,故正确;
⑦SO2有毒,不能用于漂白食品,故错误;
⑧铝热反应放出大量的热能够熔化钢轨,可用于焊接钢轨,而不是氧化铝,故错误;
⑨NH3具有易液化的性质,可用作制冷剂,故正确;
⑩AgI易与空气中水蒸气结合形成晶核,AgI易与空气中水蒸气结合形成晶核,常用于人工降雨,故正确.
故选B.
点评 本题考查了物质的用途,明确物质的性质即可解答,侧重对基础知识点的考查,会运用化学知识解释生活常识,题目有利于培养学生良好的科学素养,题目难度不大.


科目:高中化学 来源: 题型:解答题
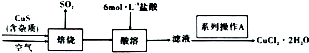
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L H2中含有的H原子数是NA | |
| B. | 标准状况下,11.2L CCl4含有0.5NA个分子 | |
| C. | 0.1 mol C含质子数为1.2NA | |
| D. | 2.3g金属钠含有的电子数为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8mol/L | B. | 1.6mol/L | C. | 0.9mol/L | D. | 1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、NO3-、Cl- | B. | Mg2+、NH4+、SO42-、NO3- | ||
| C. | H+、K+、Cl-、CO32- | D. | K+、Mg2+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
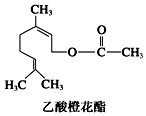
| A. | 分子式为C12H20O2 | |
| B. | 1 mol该有机物水解时只能消耗1 mol NaOH | |
| C. | 1mol该有机物可消耗3molH2 | |
| D. | 不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有NA个水分子 | |
| B. | 常温常压下,28gCO中所含的原子数目为2NA | |
| C. | 如果11.2LN2中含有n个分子,则阿伏加德罗常数一定为2n | |
| D. | 1L 1mo1/L的NaHSO4溶液中,HSO4-离子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:填空题
醇是重要的有机化工原料。一定条件下,甲醇可同时发生下面两个反应:
i .2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ii.2CH3OH(g) C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
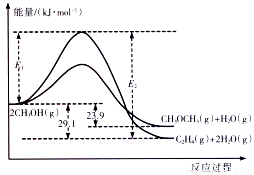
(1)在某密闭容器中,充入一定量CH3OH(g)发生上述两个反应,反应________(填“i”或“ii”)的速率较大,其原因为___________。若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1__________;E2-E1___________(填“增大”、“减小”或“不变”)。
(2)已知:CH3CH2OH(g)=CH3OCH3(g) ?ΔH =+50.7 kJ·mol-1。则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的ΔH= 。
(3)若在容积为2 L的恒容密闭容器中发生i 、ii反应,当起始投料为2 mol CH3OH(g) 的消耗量为80%时容器中气体的平均相对分子质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com