
| A. | NaCl晶体中每个钠离子与周围6个氯离子形成6个离子键 | |
| B. | 前四周期元素的原子中,未成对电子数最多的是Mn | |
| C. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| D. | 岩浆冷却过程中,晶格能高的矿物晶体先结晶 |
分析 A.氯化钠晶体中钠离子或氯离子的配位数都是6,但不是形成6个离子键;
B.第四周期元素中,外围电子排布为ndx(n+1)sy,且能级处于半满稳定状态时,含有的未成对电子数最多;
C.金属导电的原因是有自由电子,金属里本来就存在有自由电子;
D.岩浆晶出规则:晶格能高的晶体熔点较高,更容易在岩浆冷却过程中先结晶.
解答 解:A.氯化钠晶体中钠离子或氯离子的配位数都是6,但不是形成6个离子键,1个钠离子和1个氯离子形成离子键,故A错误;
B.第四周期元素中,外围电子排布为ndxnsy,且能级处于半满稳定状态时,含有的未成对电子数最多,即外围电子排布为3d54s1,此元素为铬,故B错误;
C.金属里本来就存在有自由电子,在金属未通电的情况下,金属中的电子是在做热运动,即无规则运动,在外加电场的作用下自由电子做定向移动,而不是产生了自由电子,故C错误;
D.晶格能是气态离子形成1摩尔离子晶体释放的能量,通常取正值;晶格能越大,形成的离子晶体越稳定,而且熔点越高,晶格能高的矿物晶体先结晶,故D正确.
故选D.
点评 本题主要考查较为综合,涉及离子键、核外电子排布、金属晶体以及晶格能等知识,为高频考点,侧重于学生的分析能力和双基的考查,掌握相关的概念内涵是解答的关键,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖的最简式(实验式):CH2O | B. | 乙烯的结构简式为:CH2CH2 | ||
| C. | 氮气的电子式: | D. | 核内有8个中子的碳原子:86C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | HOCH2CH2OH | C. | HOOC-COOH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
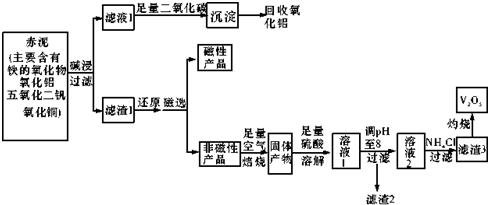
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com