
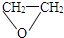 ,故答案为:CH2=CHOH;CH3CHO;
,故答案为:CH2=CHOH;CH3CHO;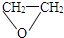 ;
;| △ |
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料. 查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:新课程模块教与练·高中化学必修2(苏教版) 苏教版 题型:058
化学反应的实质是“旧键断裂,新键形成”.在一定条件下,一个乙醇分子断键失去2个氢原子后,生成的产物可能为(写结构简式)________.
根据你已经学过的知识和提供的试剂、仪器,实现上述的某一种转化,并验证该转化后的产物.
试剂:无水乙醇、光亮的铜丝、NaOH溶液、CuSO4溶液.
仪器:试管、试管夹、镊子、胶头滴管、酒精灯.
(1)乙醇的转化:
①实验中观察到的现象是________;
②转化的化学方程式是________.
(2)产物的验证:
①该产物含有官能团的名称是________;
②已知,具有相同官能团的物质具有相似的化学性质,试利用这一原理验证反应产物:首先,要配制的试剂是________,然后将该试剂与反应产物混合并加热到沸腾,观察到现象是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知碳的燃烧热△H=-393.5KJ/mol,完全燃烧10mol碳释放的热量为 KJ。
(2)实验测得6.4 g 乙醇在氧气中充分燃烧生成CO2(g)和H2O(l)时释放出113.5KJ的热量,试写出乙醇燃烧热的热化学方程式:
(3)从化学键的角度分析,化学反应的实质就是反应物的化学键的断裂和生成物的化学键的形成过程。已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 (g)+ 3H2(g) ![]() 2NH3 (g) ΔH = -92.4 KJ/mol,则 N≡N 键的键能是 KJ/mol
2NH3 (g) ΔH = -92.4 KJ/mol,则 N≡N 键的键能是 KJ/mol
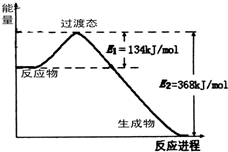
(4)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1的变化是_______(填“增大”、“减小”或“不变”),对反应热是否有影响?__________,原因是_________

(5)根据以下3个热化学方程式,判断Q1、Q2、Q3三者大小关系是
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H = Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H = Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H = Q3 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com