
分析 (1)AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,所以溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{\frac{Ksp(AgI)}{c(A{g}^{+})}}{\frac{Ksp(AgCl)}{c(A{g}^{+})}}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$;
(2)AgCl是水溶液中存在溶解平衡,AgCl电离银离子和氯离子,银离子或氯离子都抑制AgCl溶解,但硝酸银溶液中银离子浓度最大;在100mL 0.1mol/L氯化镁溶液中,c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$;
(3)正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量.
解答 解:(1)AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,所以溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{\frac{Ksp(AgI)}{c(A{g}^{+})}}{\frac{Ksp(AgCl)}{c(A{g}^{+})}}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{1.77×1{0}^{-10}}$=4.8×10-7,
故答案为:4.8×10-7;
(2)AgCl是水溶液中存在溶解平衡,AgCl电离银离子和氯离子,银离子或氯离子都抑制AgCl溶解,硝酸银是可溶性强电解质,虽然抑制氯化银溶解,但硝酸银在水溶液中的溶解度大,所以硝酸银溶液中银离子浓度最大;在100mL 0.1mol/L氯化镁溶液中,c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.77×1{0}^{-10}}{0.2}$mol/L=8.85×10-10mol/L;
故答案为:⑤;8.85×10-10mol/L;
(3)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299.
点评 本题考查以离子浓度大小比较为载体考查难溶物的溶解平衡,侧重考查学生分析计算能力,注意溶度积常数的灵活运用,易错点是(2)中银离子浓度最大溶液判断,很多同学往往因为硝酸银溶液抑制氯化银溶解而认为硝酸银溶液中离子浓度很小而导致错误,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子中三个碳原子在一条直线上 | |
| B. | 符合通式CnH2n+2的均属于烷烃 | |
| C. | 丙烷的二氯代物有5种 | |
| D. | 丁烷能与氯气在光照时发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
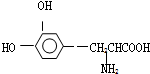 这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )| A. | 该有机物可看作氨基酸,也可看作是酚类物质 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 分子中至少有7个碳原子在同一平面内 | |
| D. | 既能与溴水发生取代反应,又能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,其单体不可能具有的化学性质是( )
,其单体不可能具有的化学性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 与NaOH溶液共热可生成一种钠盐 | ||
| C. | 能催化加氢生成2甲基丙酸甲酯 | D. | 能发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、NaCl、CO2 | B. | HF、HCl、HBr | C. | NaCl、KCl、RbCl | D. | Na、Mg、Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com