
【题目】1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.lmol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
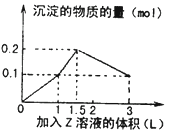
A.氯化铝、氯化铁、氢氧化钠 B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸 D.偏铝酸钠、氯化钡、硫酸
【答案】C
【解析】
试题分析 :A.若X、Y、Z分别为氯化铝、氯化铁、氢氧化钠,开始滴入氢氧化钠时,Al3 + + 3OH- = Al(OH)3↓,Fe3 + + 3OH- = Fe(OH)3↓,n(Al3 + ) :n(OH-) = 1 :3,n(Fe3 + ) :n(OH-) = 1 :3,继续滴加Al(OH)3 + OH- = AlO2- + 2H2O,n(Al(OH)3) :n(OH-) = 1 :1,不符合图象的数值变化,故A错误;B.若X、Y、Z分别为氯化铝、氯化镁、氢氧化钠,开始滴入氢氧化钠时,Mg2 + + 2OH- = Mg(OH)2↓,Al3 + + 3OH- = Al(OH)3↓,n(Mg2 + ) :n(OH-) = 1 :2,n(Al3 + ) :n(OH-) = 1 :3,继续滴加Al(OH)3 + OH- = AlO2- + 2H2O,n(Al(OH)3) :n(OH-) = 1 :1,不符合图象的数值变化,故B错误;C.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时OH- + H + = H2O,Ba2 + + SO42- = BaSO4↓,H + + AlO2- + H2O = Al(OH)3↓,图中第一段直线 :氢氧化钡的OH-和硫酸里的H + 1 :1中和,同时Ba2 + 和SO42-1 :1反应生成硫酸钡沉淀,Ba2 + + 2OH- + 2H + + SO42- = BaSO4↓ + 2H2O;图中第二段直线氢氧化钡消耗完,硫酸继续滴加,氢离子开始和偏铝酸根离子反应H + + AlO2- + H2O = Al(OH)3↓,硫酸的消耗量(硫酸消耗量是氢离子消耗量的一半)和沉淀的生成量是1 :2;图中第三段直线 :硫酸进一步过量,开始消耗沉淀,Al(OH)3 + 3H + = Al3 + + 3H2O硫酸和沉淀消耗量应为1.5 :1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4,以上三段符合图象的数值变化,故C正确;D.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时Ba2 + + SO42- = BaSO4↓,H + + AlO2- + H2O = Al(OH)3↓,Al(OH)3 + 3H + = Al3 + + 3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】(1)有以下四种物质 ①22g二氧化碳;②5g氢气;③1.204╳1024个氮气分子; ④4℃时18g水,它们所含分子数最多的是 ;质量最大的是 ;常温时体积最大的是 (填序号)。
(2)已知反应
①SO3+H20=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④2Na+2H2O=4NaOH+H2↑
⑤SiO2+2NaOH=Na2SiO3+H2O
上述反应中不属于氧化还原反应的是 (填序号,下同);属于氧化还原反应,其中H2O被氧化的是____ _ ;H2O被还原的是_ ;属于氧化还原反应,但H2O既不被氧化,也不被还原的是 。
(3)现有下列十种物质:
①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体 ⑥SO2 ⑦CuSO4固体 ⑧K2O固体 ⑨液态H2SO4⑩液氯
上述物质中可导电的是 (填序号,下同);上述物质中不能导电,但属于电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温密闭容器中,投入一定量的A发生可逆反应:A(s)![]() B(g)+C(g),△H=-Q kJ/mol(Q>O)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
B(g)+C(g),△H=-Q kJ/mol(Q>O)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
A. 两次平衡时,C(g)的浓度相等
B. 平衡时,单位时间内n(B)生成:n(C)消耗=1:1
C. 若再向平衡体系中加入少量A,平衡不移动
D. 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收QkJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH=8的NaOH溶液和pH=10的Ba(OH)2溶液等体积混合,若忽略混合过程的体积变化,则混合液的pH约为
A.8.3 B.8.7 C.9.3 D.9.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
A.2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2
B.S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2
C.C(s)+![]() O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
D.H2(g)+Cl2(g)═2HCl(g);△H1 ![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g);△H2
Cl2(g)═HCl(g);△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 聚乙烯是混合物,能使溴的四氯化碳溶液褪色
B. 苯、溴水、铁粉混合制成溴苯
C. 沸点:戊烷>丙烷>乙烷
D. 烷烃可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题:

(1)分别写出①②的数值:①___________KJ;②____________KJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)==H2O(g) ΔH = + 44 kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下![]() =12的溶液:Fe2+、Mg2+、NO3-、Cl-
=12的溶液:Fe2+、Mg2+、NO3-、Cl-
C.含有大量Al3+的溶液中:Na+、Cl-、AlO2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
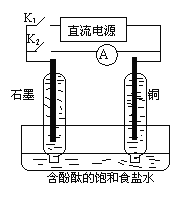
A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com