
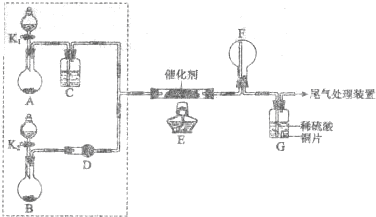

分析 (1)氨的催化氧化产物是一氧化氮和水,据此来书写反应方程式;
(2)根据化学平衡移动的影响因素解答;
(3)①氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
②氨气和硝酸反应生成硝酸铵;
③二氧化氮和水反应获得硝酸,铜和硝酸反应生成硝酸铜、一氧化氮和水;
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量;
②在F中看到红棕色的二氧化氮,避免生成硝酸铵,需不生成硝酸,需除去水或氨气,在装置E、F间增加一个装置,该装置可以是将氨气或水除去,剩下一氧化氮和未反应的氧气.
解答 解:(1)氨的催化氧化反应,氨气中-3价的氮被氧气氧化成显+2价的一氧化氮,化学反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)B装置是氨水滴入到氢氧化钠固体上,NaOH固体溶于水放出大量热,氨气在温度高的情况下溶解度小,在氨水中存在平衡:NH3+H2O?NH3•H2O?NH4++OH-,平衡向左移动;加入NaOH固体,氢氧化钠电离出氢氧根离子,OH-浓度增加,平衡向左移动,
故答案为:在氨水中存在平衡:NH3+H2O?NH3•H2O?NH4++OH-,加入NaOH固体,OH-浓度增加,平衡向左移动,NaOH固体溶于水放出大量热,均有利于NH3逸出;
(3)①氨气发生了催化氧化的产物一氧化氮,一氧化氮极易和氧气化合为二氧化氮,即2NO+O2=2NO2;所以装置F中有红棕色气体产生,
故答案为:2NO+O2═2NO2;
②乙观察到装置F中只有白烟生成,白烟是由于氨气和硝酸反应NH3+HNO3=NH4NO3,生成了白色的NH4NO3固体,
故答案为:NH4NO3;
③在装置G中,生成的二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO2+H2O═2HNO3+NO,获得硝酸,金属铜和硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O实质是:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量,A为制氧气的装置,增加A中氧气的量,装置A中的产气量,装置B中的产气量,
故答案为:增加; 减少;
②E装置是氨气的催化氧化装置,从装置中出来的气体中有氧气和氨气和一氧化氮和水蒸气,因4NO+2H2O+3O2=4HNO3,NH3+HNO3=NH4NO3,所以避免F中生成硝酸铵,实现在F中看到红棕色的二氧化氮,需除去水或氨气,需在装置E、F间增加一个装置,该装置可以将氨气或水除去,a碱石灰吸收水蒸气,可以通过防倒吸的b装置吸收氨气,可以通过浓硫酸吸收氨气和水蒸气,实现在F中看到红棕色的二氧化氮,需选abc,
故答案为:abc.
点评 本题主要考查了氨气的催化氧化,解答须掌握该反应的原理和相关物质的性质,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
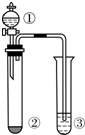 下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )
下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 水 | 电石 | CuSO4溶液 | 乙炔具有还原性 |
| B | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| C | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | 溶解度:AgCl>Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极反应式为Cn[AlCl4]+e-═[AlCl4]-+Cn | |
| B. | 充电时,阴极反应式为4[Al2Cl7]-3e-═Al+7[AlCl4]- | |
| C. | 放电过程中,负极每消耗1mol Al,导线中转移的电子数为3NA(NA为阿伏伽德罗常数的值) | |
| D. | 充、放电过程中,R+的移动方向相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 实验现象与结论 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com