
(10分)已知H2A在水中存在以下平衡:H2A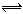 H++HA-,HA-
H++HA-,HA-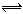 H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定” ,下同),某二元酸H2B电离方程式是:H2B H++HB-,HB-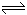 B2-+H+, NaHB溶液________。
B2-+H+, NaHB溶液________。
(2)某温度下,向0.1 mol/L的NaHA溶液中滴入0.1 mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2/L2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) 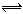 Ca2+(aq)+A2-(aq) ΔH>0。
Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。
(共10分)
(1)酸碱性无法确定(2分),酸性(2分)
(2)BC (2分)
(3)①增大(1分) ②增大(1分) 加盐酸发生反应:A2-+H+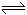 HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大(2分)
HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大(2分)
【解析】
试题分析:(1)HA-在水溶液中既发生水解使溶液呈碱性,又能发生电离使溶液呈酸性,但二者的程度未知,所以最终溶液的酸碱性未知,所以填酸碱性无法确定;H2B的第一步完全电离,说明HB-不会发生水解,只是电离,所以使溶液呈酸性;
(2)A、未说明溶液的温度是常温,所以NaHA溶液c(H+)·c(OH-)不一定等于1×10-14 mol2/L2,错误;B、根据电荷守恒及溶液中的离子,有c(HA-)+2c(A2-)+c(OH-)= c(H+)+ c(Na+)+c(K+)且溶液呈中性c(OH-)= c(H+),所以c(Na+)+c(K+)=c(HA-)+2c(A2-),正确;C、由题意可知NaHA溶液与KOH混合后呈中性,说明NaHA溶液呈酸性,若二者等体积混合恰好完全反应,则混合后的溶液呈碱性,与题意不符,所以NaHA溶液过量,钠离子的物质的量大于钾离子的物质的量,c(Na+)>c(K+),正确;D、根据C的分析,NaHA溶液过量,所以混合后c(Na+)+c(K+)>0.05 mol/L,错误,答案选BC;
(3)①溶解平衡是吸热反应,温度升高,平衡正向移动,所以Ksp增大;
②加少量盐酸,A2-与H+结合生成HA-使溶解平衡正向移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大。
考点:考查盐溶液酸碱性的判断、溶液中离子浓度的关系、外界条件对化学平衡的影响


科目:高中化学 来源:2014-2015河北保定某重点中学同步作业(必修1苏教版)1.1.3物质的状态 题型:填空题
已知实验室在加热条件下制取Cl2的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积为 。
(2)反应的HCl的分子数为 。
(3)向反应后的溶液中加入足量的AgNO3溶液,可生成白色沉淀的质量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高二上期开学考试化学试卷(解析版) 题型:选择题
已知0.1 mol?L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加醋酸钠 C. 加少量冰醋酸 D. 加水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(B类)试卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(B类)试卷(解析版) 题型:选择题
下列反应属于放热反应的是

A.能量变化如图所示的反应
B.燃烧反应和铝热反应
C.化学键断裂吸收的热量比化学键生成放出的热量多的反应
D.氢氧化钡晶体和氯化铵晶体的反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(A类)试卷(解析版) 题型:选择题
在Na2HPO4溶液中,存在着下列平衡:HPO42-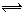 H++PO43-;HPO42-+H2O
H++PO43-;HPO42-+H2O 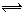 H2PO4-+OH-;已知该溶液呈碱性。欲使溶液中的HPO42-、H+、PO43-浓度都减小,可采取的方法是( )
H2PO4-+OH-;已知该溶液呈碱性。欲使溶液中的HPO42-、H+、PO43-浓度都减小,可采取的方法是( )
A.加石灰水 B.加盐酸 C.加烧碱 D.用水稀释
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(A类)试卷(解析版) 题型:选择题
关于吸热反应的说法,正确的是( )
A.凡需加热的反应一定是吸热反应 B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应 D.酸碱中和反应的逆反应是吸热反应
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(8分)甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:③2H2(g)+ O2(g) = 2H2O(g) ΔH3 。则2CO(g)+O2(g)=2CO2(g) 的反应热
ΔH=______(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、 减小、不变)。负极的电极反应式为_______ ____。

(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;阳极泥为: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com