
| A. | 高温下60gSiO2与足量纯碱反应,最多释放出2NA个气体分子 | |
| B. | 1molC5H12分子中共价键总数为14NA | |
| C. | 78gNa2O2固体与足量的H2O反应转移的电子数为NA | |
| D. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2NA |
分析 A.质量换算物质的量结合二氧化硅和碳酸钠反应计算生成的二氧化碳气体;
B.1个C5H12分子含有4个C-C,12个C-H;
C.过氧化钠中氧元素的化合价为-1价,1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子;
D.2.24L NH3和CH4的混合气体,标准状况下都是0.1mol,总共含有1mol电子.
解答 解:A.60gSiO2物质的量为1mol,发生反应SiO2+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+CO2,生成二氧化碳为1mol,最多可释放出的气体分子数为NA,故A错误;
B.1molC5H12分子中含有4molC-C,12molC-H,共价键总数为16NA,故B错误;
C.78gNa2O2固体物质的量为$\frac{78g}{78g/mol}$=1mol,1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子,个数为NA,故C正确;
D.标准状况下,2.24L NH3和CH4的混合气体的物质的量是0.1mol,含有1mol电子,所含电子总数为NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意有机物结构特点,题目难度中等.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯的单体是CH2=CHCl | |
| B. | 通过加聚反应得到的聚乙烯属于天然高分子化合物 | |
| C. | 聚乙烯的链节是CH2=CH2 | |
| D. | 聚乙烯的产量是衡量一个国家石油化工发展水平的标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
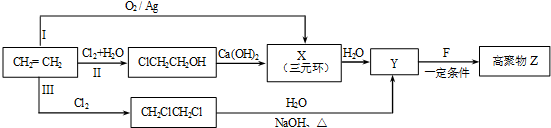
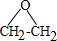 .
.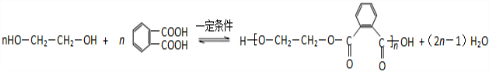 .
.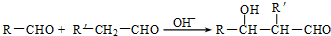 (R、R'代表烃基或氢原子).合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.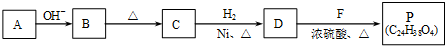
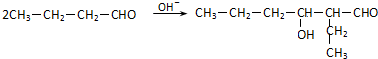 .
.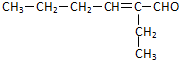 .
.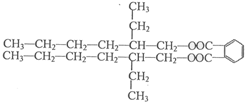 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
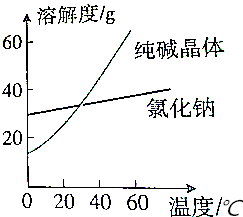
| A. | 蒸馏法 | B. | 苹取法 | C. | 结晶法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16mol | B. | 18mol | C. | 20mol | D. | 24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
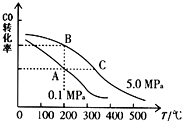 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电了式: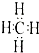 | B. | 乙炔的结构简式:CHCH | ||
| C. | 硫离子的结构示意图: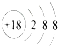 | D. | 中子数为10的原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液吸收过量的二氧化碳:OH-+CO2═HCO3- | |
| B. | 亚硫酸氢铵溶液与足量氢氧化钠溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | 氯气通入冷水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | 碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com