
 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.分析 (1)根据浓硫酸和二氧化硫的性质分析,浓度大时硫酸以分子形式存在,硫酸稀时,二氧化硫易溶于水,据此分析.
(2)根据实验目的及二氧化硫的性质分析,应制取干燥的二氧化硫气体,为控制液体的量,应选取易控制流量的仪器;
(3)根据二氧化硫、品红溶液、品红酒精溶液的性质分析;
(4)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,根据溶液中存在的含硫微粒判断.
解答 解:(1)硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,如果硫酸浓度过大,硫酸是以分子形式存在,没有电离出H+,不能反应生成SO2;如果硫酸浓度过低,二氧化硫易溶于水,不利于二氧化硫放出,所以选取70%硫酸,故选B,
故答案为:B;98%的浓硫酸H+浓度小不易反应,10%硫酸浓度太稀不利于SO2放出;
(2)为控制硫酸的流量应选取分液漏斗,该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥,
故答案为:不能用长颈漏斗,应改用分液漏斗;缺少二氧化硫的干燥装置;
(3)二氧化硫和水反应生成亚硫酸,二氧化硫和酒精不反应,二氧化硫能使品红溶液褪色而不能使品红的酒精溶液褪色,由此得出S02的漂白作用是SO2与水作用的产物导致的,二氧化硫和水反应生成亚硫酸、亚硫酸电离生成亚硫酸氢根离子、亚硫酸氢根离子电离生成亚硫酸根离子,所以使品红的水溶液褪色的微粒可能是:HSO3-、SO32-、H2SO3,
故答案为:HSO3-、SO32-、H2SO3;
(4)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO3-、SO32-、H2SO3,所以不能确定使品红褪色的微粒肯定是HSO3-或SO3 2-,
故答案为:不正确;因为亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
点评 本题考查了探究二氧化硫漂白性的实验,明确各物质的性质是解本题关键,注意采用对比方法进行分析,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 向碘水中加入适量酒精,可以将碘单质萃取出来 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发时,当溶液中出现大量晶体时,停止加热余热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
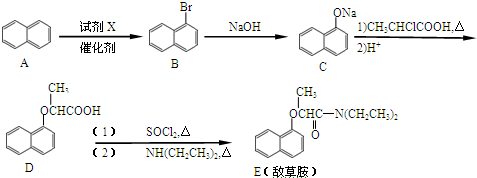
 .
.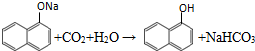 ;
;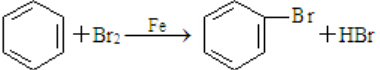 、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
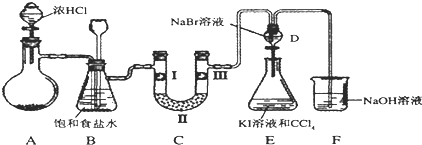
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②⑤⑧ | C. | ①②③④⑦ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com