
已知在1×105 Pa,298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下
列热化学方程式正确的是
A.H2O(g)= H2(g)+ O2 (g)△H =+242 kJ/mol O2 (g)△H =+242 kJ/mol |
| B.2H2(g)+ O2 (g)= 2H2O (l)△H =-484 kJ/mol[来 |
C.H2 (g)+  O2 (g) O2 (g) = H2O = H2O (l)△H =-242 kJ/mol (l)△H =-242 kJ/mol |
| D.2H2 (g)+ O2 (g)= 2H2O (g)△H =+484 kJ/mol |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:阅读理解
| 压强(Pa) | 4×105 | 6×105 | 1×106 | 2×106 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
查看答案和解析>>
科目:高中化学 来源: 题型:
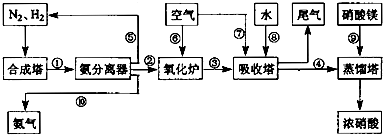
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
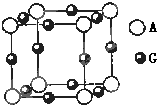 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源:2014届贵州省遵义市高三五校联考理综化学试卷(解析版) 题型:填空题
(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g
) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
|
实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为 (填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为 。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
|
压强p/Pa |
2×105 |
5×105 |
1×106 |
|
c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为 mol/L 。(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
查看答案和解析>>
科目:高中化学 来源: 题型:
(08安师大附中二模)已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 KJ热量,下列热化学方程式正确的是 ( )
A. H2O(g) == H2(g)+1/2 O2(g); △H1=+242 kJ?mol-1
B. 2 H2(g)+ O2(g)===2 H2O(l); △H2=- 484 kJ?mol-1
C. H2(g)+1/2 O2(g)====H2O(g) ; △H1=+242 kJ?mol-1
D. 2 H2(g)+ O2(g)===2 H2O(g); △H2=+484 kJ?mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com