
| A. | 断开化学键的过程会放出能量 | |
| B. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 化合反应均为放热反应 |
分析 A、旧化学键的断裂需要吸收能量;
B、反应物的总能量大于生成物的总能量,该反应放热;
C、吸热反应不一定需要加热热才发生,加热才能发生的反应不一定是吸热反应;
D、化合反应可能为吸热反应,也可能为放热反应.
解答 解:A、断开化学键的过程会吸收能量,故A错误;
B、当反应物的总能量大于生成物的总能量时,该反应是放热反应,故B正确;
C、吸热反应不一定需要加热热才发生,如氯化铵和十水合氢氧化钡的反应就是吸热的,加热才能发生的反应不一定是吸热反应,如铝热反应,故C错误;
D、C与氧气的化合反应为放热反应,C和二氧化碳的化合反应为吸热反应,故D错误.
故选B.
点评 本题考查反应热,为高频考点,把握常见反应中的能量变化为解答的关键,注意焓变的计算及常见的吸热反应、放热反应,明确四种基本反应类型与反应中能量变化没有必然的联系,题目难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
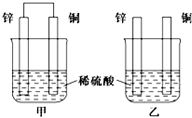 (1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器体积 | B. | 体积不变,充入N2使压强增大 | ||
| C. | 体积不变,充入He使压强增大 | D. | 压强不变,充入N2使体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
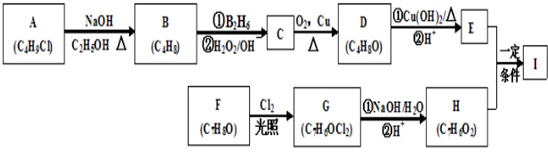
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:N>O>F | B. | 酸性强弱:H2SO4>H2SiO3>H2CO3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2 | D. | 氢化物的稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com