
| A、Na2SO4═2Na++SO42- |
| B、Ba(OH)2═Ba+2+2OH- |
| C、Al2(SO4)3═2Al3++3SO42- |
| D、Ca(NO3)2═Ca2++2(NO3)2- |


科目:高中化学 来源: 题型:
| A、亚硝酸盐是氧化剂 |
| B、维生素C是氧化剂 |
| C、亚硝酸盐将Fe3+还原成Fe2+ |
| D、维生素C被Fe3+氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
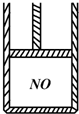 如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )
如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )| A、等于1.369g?L-1 |
| B、等于2.054g?L-1 |
| C、在1.369g?L-1和2.054g?L-1之间 |
| D、在2.054g?L-1和4.108g?L-1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、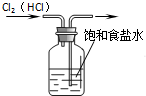 除去Cl2中的HCl杂质 |
B、 稀释浓H2S04 |
C、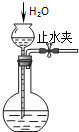 检查装置气密性 |
D、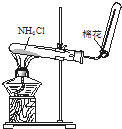 实验室制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H和3H的质子数相同,它们是同种核素 |
| B、6Li和7Li的质子数相等,电子数也相等 |
| C、14C和14N的质量数相等,它们的中子数相等 |
| D、13C和14C属于同一种元素,它们的质量数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
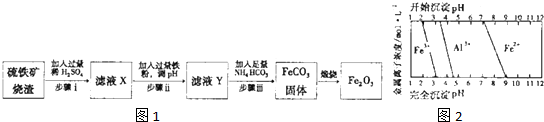
| 微粒平衡 | 平衡常数 | ||||
Fe3CO3(s)?Fe2+(aq)+CO
| Ksp=3.2×10-11 | ||||
H2CO3?H++HCO
| Ka1=4.36×10-7 | ||||
HCO
| Ka2=4.68×10-11 | ||||
2HCO
| K=1.3×-4 |
- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com