
ĮņĖį³§ÓĆģŃÉÕ»ĘĢśæó(FeS2)ÖĘČ”ĮņĖį£¬ŹµŃéŹŅĄūÓĆĮņĖį³§ÉÕŌü(Ö÷ŅŖ³É·ÖŹĒFe2O3¼°ÉŁĮæFeS”¢SiO2ÖʱøĀĢ·Æ”£
£ØŅ»£©SO2ŗĶO2·“Ó¦ÖĘČ”µÄ·“Ó¦ŌĄķĪŖ£ŗ2SO2£«O2 2SO3£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠŅ»¶ØŹ±¼äÄŚ“ļµ½Ę½ŗā”£
2SO3£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠŅ»¶ØŹ±¼äÄŚ“ļµ½Ę½ŗā”£
£Ø1£©øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ______”£
£Ø2£©øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ______”£
A£®v(SO2)=v(SO3) B£®»ģŗĻĪļµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä
C£®»ģŗĻĘųĢåÖŹĮæ²»±ä D£®ø÷×é·ÖµÄĢå»ż·ÖŹż²»±ä
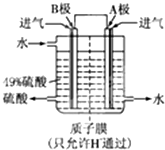
£Ø¶ž£©Ä³æĘŃŠµ„Ī»ĄūÓĆŌµē³ŲŌĄķ£¬ÓĆSO2ŗĶO2ÖʱøĮņĖį£¬×°ÖĆČēĶ¼£¬µē¼«ĪŖ¶ąæ׵IJÄĮĻ£¬ÄÜĪüø½ĘųĢ壬Ķ¬Ź±Ņ²ÄÜŹ¹ĘųĢåÓėµē½āÖŹČÜŅŗ³ä·Ö½Ó“„”£

£Ø3£©Bµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ______£»ČÜŅŗÖŠH£«µÄŅĘ¶Æ·½ĻņÓÉ______¼«µ½______¼«£»µē³Ų×Ü·“Ó¦Ź½ĪŖ______”£
£ØČż£©ĄūÓĆÉÕŌüÖĘĀĢ·ÆµÄ¹ż³ĢČēĻĀ
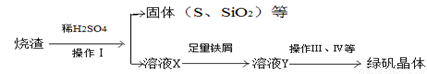
²ā¶ØĀĢ·Æ²śĘ·ÖŠŗ¬ĮæµÄŹµŃé²½Öč£ŗ
a£®³ĘČ”5.7 g²śĘ·£¬Čܽā£¬Åä³É250 mL”£ČÜŅŗ”£
b£®ĮæČ”25 ml”£“ż²āŅŗӌ׶ŠĪĘæÖŠ”£
c£®ÓĆĮņĖįĖį»ÆµÄ0. 01 mol/LKMnO4 ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄKMnO4ČÜŅŗĢå»ż40 mL”£øł¾ŻÉĻŹö²½ÖčĶ¬“šĻĀĮŠĪŹĢā”£
£Ø4£©µĪ¶ØŹ±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ØĶź³É²¢ÅäĘ½Ąė×Ó·“Ó¦·½³ĢŹ½£©”£

£Ø5£©ÓĆĮņĖįĖį»ÆµÄKMnO4µĪ¶ØÖÕµćµÄ±źÖ¾ŹĒ
£Ø6£©¼ĘĖćÉĻŹö²śĘ·ÖŠµÄFeSO4.7H2OÖŹĮæ·ÖŹżĪŖ______”£
£Ø1£© £Ø2£© B D £Ø3£©SO2+2H2O-2e-=SO42-+4H+
B A
£Ø2£© B D £Ø3£©SO2+2H2O-2e-=SO42-+4H+
B A
2SO2+O2+2H2O=2H2SO4(»ņ2SO2+O2+2H2O=4H++2SO42-)£Ø4£©5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
£Ø5£©µĪ¶Ø×īŗóŅ»µĪĖįŠŌKMnO4Ź±ČÜŅŗ³Źµ×ĻÉ«£¬°ė·ÖÖÓÄŚ²»ĶŹÉ«”££Ø6£©0.975»ņ97.5%
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©·“Ó¦2SO2£«O2 2SO3µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ
2SO3µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ £Ø2£©AƻӊÖøĆ÷ŹĒÕż·“Ó¦ĖŁĀŹ»¹ŹĒÄę·“Ó¦ĖŁĀŹ£¬Ć»ÓŠŅāŅ唣“ķĪó”£B.ÓÉÓŚøĆ·“Ó¦ŹĒ·“Ó¦Ē°ŗóĘųĢåĢå»ż²»µČµÄ·“Ó¦£¬ĖłŅŌµ±·“Ó¦“ļµ½Ę½ŗāŹ±ø÷ÖÖĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬Ōņ»ģŗĻĪļµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä”£ÕżČ·”£C£®ČĪŗĪ·“Ó¦ĪŽĀŪ½ųŠŠµ½Ź²Ć“³Ģ¶Č£¬»ģŗĻĘųĢåÖŹĮæ×ÜŹĒ²»±ä£¬=”£Ņņ“Ė²»ÄÜ×÷ĪŖ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾”£“ķĪó”£D£®ÓÉÓŚøĆ·“Ó¦ŹĒ·“Ó¦Ē°ŗóĘųĢåĢå»ż²»µČµÄ·“Ó¦£¬ĖłŅŌµ±·“Ó¦“ļµ½Ę½ŗāŹ±ø÷ÖÖĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬ø÷ÖÖĘųĢåµÄĢå»żŅ²²»±ä£¬×ÜĢå»ż²»±ä£¬ĖłŅŌø÷×é·ÖµÄĢå»ż·ÖŹż²»±ä”£ÕżČ·”£ĖłŅŌøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒB D”££Ø3£©ŅņĪŖŌŚBµē¼«Ēų²śÉśH2SO4£¬ĖµĆ÷SO2ŌŚBµē¼«ÉĻŹ§Č„µē×Ó£¬Ņņ“ĖBµē¼«ĪŖŃō¼«£¬µē¼«·“Ó¦Ź½ĪŖSO2+2H2O-2e-=SO42-+4H+øł¾ŻĶ¬ÖÖµēŗÉĻą»„Åųā£¬ŅģÖÖµēŗÉĻą»„ĪüŅżµÄŌŌņ£¬ČÜŅŗÖŠH£«µÄŅĘ¶Æ·½ĻņÓÉBµē¼«µ½Aµē¼«”£µē³Ų×Ü·“Ó¦Ź½ĪŖ2SO2+O2+2H2O=2H2SO4”££Ø4£©µĪ¶ØŹ±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O”££Ø5£©ÓÉÓŚKMnO4ĪŖ×ĻÉ«£¬ĖłŅŌ²»ÓĆĶā¼ÓÖøŹ¾¼Į£¬ĄūÓĆĘä±¾ÉķµÄŃÕÉ«±ä»ÆĄ“ÅŠ¶Ļ·“Ó¦ÖÕµć”£Ņņ“ĖÓĆĮņĖįĖį»ÆµÄKMnO4µĪ¶ØÖÕµćµÄ±źÖ¾ŹĒµĪ¶Ø×īŗóŅ»µĪĖįŠŌKMnO4Ź±ČÜŅŗ³Źµ×ĻÉ«£¬°ė·ÖÖÓÄŚ²»ĶŹÉ«”£n(KMnO4)= 0. 01 mol/L”Į0.04L”Į(250”Ā25)=4”Į10-3mol.Ōņn(Fe2+)=5 n(KMnO4)= 5”Į4”Į10-3mol=0.02mol.ĖłŅŌÉĻŹö²śĘ·ÖŠµÄFeSO4.7H2OÖŹĮæ·ÖŹżĪŖ(0.02mol”Į278g/mol) ”Ā5.7 g”Į100%=97.5%.
£Ø2£©AƻӊÖøĆ÷ŹĒÕż·“Ó¦ĖŁĀŹ»¹ŹĒÄę·“Ó¦ĖŁĀŹ£¬Ć»ÓŠŅāŅ唣“ķĪó”£B.ÓÉÓŚøĆ·“Ó¦ŹĒ·“Ó¦Ē°ŗóĘųĢåĢå»ż²»µČµÄ·“Ó¦£¬ĖłŅŌµ±·“Ó¦“ļµ½Ę½ŗāŹ±ø÷ÖÖĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬Ōņ»ģŗĻĪļµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä”£ÕżČ·”£C£®ČĪŗĪ·“Ó¦ĪŽĀŪ½ųŠŠµ½Ź²Ć“³Ģ¶Č£¬»ģŗĻĘųĢåÖŹĮæ×ÜŹĒ²»±ä£¬=”£Ņņ“Ė²»ÄÜ×÷ĪŖ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾”£“ķĪó”£D£®ÓÉÓŚøĆ·“Ó¦ŹĒ·“Ó¦Ē°ŗóĘųĢåĢå»ż²»µČµÄ·“Ó¦£¬ĖłŅŌµ±·“Ó¦“ļµ½Ę½ŗāŹ±ø÷ÖÖĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬ø÷ÖÖĘųĢåµÄĢå»żŅ²²»±ä£¬×ÜĢå»ż²»±ä£¬ĖłŅŌø÷×é·ÖµÄĢå»ż·ÖŹż²»±ä”£ÕżČ·”£ĖłŅŌøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒB D”££Ø3£©ŅņĪŖŌŚBµē¼«Ēų²śÉśH2SO4£¬ĖµĆ÷SO2ŌŚBµē¼«ÉĻŹ§Č„µē×Ó£¬Ņņ“ĖBµē¼«ĪŖŃō¼«£¬µē¼«·“Ó¦Ź½ĪŖSO2+2H2O-2e-=SO42-+4H+øł¾ŻĶ¬ÖÖµēŗÉĻą»„Åųā£¬ŅģÖÖµēŗÉĻą»„ĪüŅżµÄŌŌņ£¬ČÜŅŗÖŠH£«µÄŅĘ¶Æ·½ĻņÓÉBµē¼«µ½Aµē¼«”£µē³Ų×Ü·“Ó¦Ź½ĪŖ2SO2+O2+2H2O=2H2SO4”££Ø4£©µĪ¶ØŹ±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O”££Ø5£©ÓÉÓŚKMnO4ĪŖ×ĻÉ«£¬ĖłŅŌ²»ÓĆĶā¼ÓÖøŹ¾¼Į£¬ĄūÓĆĘä±¾ÉķµÄŃÕÉ«±ä»ÆĄ“ÅŠ¶Ļ·“Ó¦ÖÕµć”£Ņņ“ĖÓĆĮņĖįĖį»ÆµÄKMnO4µĪ¶ØÖÕµćµÄ±źÖ¾ŹĒµĪ¶Ø×īŗóŅ»µĪĖįŠŌKMnO4Ź±ČÜŅŗ³Źµ×ĻÉ«£¬°ė·ÖÖÓÄŚ²»ĶŹÉ«”£n(KMnO4)= 0. 01 mol/L”Į0.04L”Į(250”Ā25)=4”Į10-3mol.Ōņn(Fe2+)=5 n(KMnO4)= 5”Į4”Į10-3mol=0.02mol.ĖłŅŌÉĻŹö²śĘ·ÖŠµÄFeSO4.7H2OÖŹĮæ·ÖŹżĪŖ(0.02mol”Į278g/mol) ”Ā5.7 g”Į100%=97.5%.
æ¼µć£ŗæ¼²éģŃÉÕ»ĘĢśæóÖĘČ”ĮņĖį”¢ÓĆĮņĖį³§ÉÕŌüÖʱøĀĢ·ÆµÄ·“Ó¦ŌĄķ¼°ĻąÓ¦µÄ»Æѧ¼ĘĖćµÄÖŖŹ¶”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| “߻ƼĮ |
| ”÷ |
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
| O | - 4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģĮÉÄžŹ”ÉņŃō¶žÖŠøßČżµŚĖÄ“Ī½×¶Ī²āŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
(15·Ö)ĮņĖį³§ÓĆģŃÉÕ»ĘĢśæó(FeS2)Ą“ÖĘČ”ĮņĖį£¬ŹµŃéŹŅĄūÓĆĮņĖį³§ÉÕŌü(Ö÷ŅŖ³É·ÖŹĒFe2O3¼°ÉŁĮæFeS”¢SiO2)ÖʱøĀĢ·Æ£®
¢ÅSO2ŗĶO2·“Ó¦ÖĘČ”SO3µÄ·“Ó¦ŌĄķĪŖ£ŗ2SO2+O2 2SO3£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠŅ»¶ØŹ±¼äÄŚ“ļµ½Ę½ŗā£®
2SO3£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠŅ»¶ØŹ±¼äÄŚ“ļµ½Ę½ŗā£®
¢ŁøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ£ŗ £®
¢ŚøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ £®
A£®v(SO2)=v(SO3) B£®»ģŗĻĪļµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä
C£®»ģŗĻĘųĢåÖŹĮæ²»±ä D£®ø÷×é·ÖµÄĢå»ż·ÖŹż²»±ä
¢ĘijæĘŃŠµ„Ī»ĄūÓĆŌµē³ŲŌĄķ£¬ÓĆSO2ŗĶO2Ą“ÖʱøĮņĖį£¬×°ÖĆČēĶ¼£¬µē¼«ĪŖ¶ąæ׵IJÄĮĻÄÜĪüø½ĘųĢ壬Ķ¬Ź±Ņ²ÄÜŹ¹ĘųĢåÓėµē½āÖŹČÜŅŗ³ä·Ö½Ó“„£®
¢ŁBµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ £»
¢ŚČÜŅŗÖŠH+µÄŅĘ¶Æ·½ĻņÓÉ ¼«µ½ ¼«£»(ÓĆA”¢B±ķŹ¾)
¢Ē²ā¶ØĀĢ·Æ²śĘ·ÖŠŗ¬ĮæµÄŹµŃé²½Öč£ŗ
a£®³ĘČ”5.7 g²śĘ·£¬Čܽā£¬Åä³É250 mLČÜŅŗ
b£®ĮæČ”25 mL“ż²āŅŗӌ׶ŠĪĘæÖŠ
c£®ÓĆĮņĖįĖį»ÆµÄ0.01 mol/L KMnO4ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄKMnO4ČÜŅŗĢå»ż40 mL
øł¾ŻÉĻŹö²½Öč»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁµĪ¶ØŹ±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ(Ķź³É²¢ÅäĘ½Ąė×Ó·“Ó¦·½³ĢŹ½)£®
Fe2++  + ”Ŗ”Ŗ Fe3++ Mn2++
+ ”Ŗ”Ŗ Fe3++ Mn2++
¢ŚÓĆĮņĖįĖį»ÆµÄKMnO4µĪ¶ØÖÕµćµÄ±źÖ¾ŹĒ £®
¢Ū¼ĘĖćÉĻŹö²śĘ·ÖŠFeSO4”¤7H2OµÄÖŹĮæ·ÖŹżĪŖ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğĮÉÄžŹ”øßČżµŚĖÄ“Ī½×¶Ī²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(15·Ö)ĮņĖį³§ÓĆģŃÉÕ»ĘĢśæó(FeS2)Ą“ÖĘČ”ĮņĖį£¬ŹµŃéŹŅĄūÓĆĮņĖį³§ÉÕŌü(Ö÷ŅŖ³É·ÖŹĒFe2O3¼°ÉŁĮæFeS”¢SiO2)ÖʱøĀĢ·Æ£®
¢ÅSO2ŗĶO2·“Ó¦ÖĘČ”SO3µÄ·“Ó¦ŌĄķĪŖ£ŗ2SO2+O2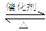 2SO3£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠŅ»¶ØŹ±¼äÄŚ“ļµ½Ę½ŗā£®
2SO3£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠŅ»¶ØŹ±¼äÄŚ“ļµ½Ę½ŗā£®
¢ŁøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ£ŗ £®
¢ŚøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ £®
A£®v(SO2)=v(SO3) B£®»ģŗĻĪļµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä
C£®»ģŗĻĘųĢåÖŹĮæ²»±ä D£®ø÷×é·ÖµÄĢå»ż·ÖŹż²»±ä
¢ĘijæĘŃŠµ„Ī»ĄūÓĆŌµē³ŲŌĄķ£¬ÓĆSO2ŗĶO2Ą“ÖʱøĮņĖį£¬×°ÖĆČēĶ¼£¬µē¼«ĪŖ¶ąæ׵IJÄĮĻÄÜĪüø½ĘųĢ壬Ķ¬Ź±Ņ²ÄÜŹ¹ĘųĢåÓėµē½āÖŹČÜŅŗ³ä·Ö½Ó“„£®
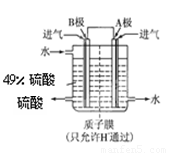
¢ŁBµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ £»
¢ŚČÜŅŗÖŠH+µÄŅĘ¶Æ·½ĻņÓÉ ¼«µ½ ¼«£»(ÓĆA”¢B±ķŹ¾)
¢Ē²ā¶ØĀĢ·Æ²śĘ·ÖŠŗ¬ĮæµÄŹµŃé²½Öč£ŗ
a£®³ĘČ”5.7 g²śĘ·£¬Čܽā£¬Åä³É250 mLČÜŅŗ
b£®ĮæČ”25 mL“ż²āŅŗӌ׶ŠĪĘæÖŠ
c£®ÓĆĮņĖįĖį»ÆµÄ0.01 mol/L KMnO4ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄKMnO4ČÜŅŗĢå»ż40 mL
øł¾ŻÉĻŹö²½Öč»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁµĪ¶ØŹ±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ(Ķź³É²¢ÅäĘ½Ąė×Ó·“Ó¦·½³ĢŹ½)£®
Fe2++  +
”Ŗ”Ŗ
Fe3++ Mn2++
+
”Ŗ”Ŗ
Fe3++ Mn2++
¢ŚÓĆĮņĖįĖį»ÆµÄKMnO4µĪ¶ØÖÕµćµÄ±źÖ¾ŹĒ £®
¢Ū¼ĘĖćÉĻŹö²śĘ·ÖŠFeSO4”¤7H2OµÄÖŹĮæ·ÖŹżĪŖ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğÕć½Ź”øßČż5ŌĀÄ£Äā²āŹŌĄķæĘ×ŪŗĻ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø14·Ö£©ĢśŹĒŅ»ÖÖ¹ż¶ÉŌŖĖŲ£¬½šŹōĢśŹĒ×ī³£ÓĆµÄ½šŹō”£Ēė»Ų“šĻĀĮŠø÷Ģā£ŗ
£Ø1£©ÉśĢśÖŠŗ¬ÓŠŅ»ÖÖĢśĢ¼»ÆŗĻĪļ(Fe3C)£¬ŌŚ×ćĮæµÄæÕĘųÖŠøßĪĀģŃÉÕ£¬Éś³ÉÓŠ“ÅŠŌµÄ¹ĢĢåŗĶÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×ĒµÄĘųĢ壬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£ÉĻŹö·“Ӧɜ³ÉµÄ“ÅŠŌ¹ĢĢåÄÜČÜÓŚ¹żĮæŃĪĖį£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø2£©ŌŚFe2+”¢Fe3+µÄ“ß»Æ×÷ÓĆĻĀ£¬æÉŹµĻÖ2SO2+O2+2H2O=2H2SO4µÄ×Ŗ»Æ”£ŅŃÖŖ£¬ŗ¬SO2µÄ·ĻĘųĶØČėFe2+”¢Fe3+µÄČÜŅŗŹ±£¬ĘäÖŠŅ»øö·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O£¬ŌņĮķŅ»·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
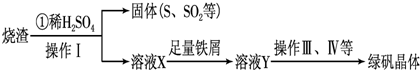
£Ø3£©ĮņĖį³§ÓĆģŃÉÕ»ĘĢśæó£ØFeS2£©Ą“ÖĘČ”ĮņĖį£¬ŹµŃéŹŅĄūÓĆĮņĖį³§ÉÕŌü£ØÖ÷ŅŖ³É·ÖŹĒFe2O3¼°ÉŁĮæFeS”¢SiO2£©ÖĘĀĢ·Æ”£ĄūÓĆÉÕŌüÖĘĀĢ·ÆµÄ¹ż³ĢČēĻĀ£ŗ

¢ŁÉÕŌüČÜÓŚĻ”H2SO4¹ż³ĢÖŠ£¬ÓŠµ„ÖŹĮņÉś³É£¬Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ØÖ»Š“Éś³ÉSµÄ·“Ó¦Ź½£¬ĘäĖū·“Ó¦ĪŽŠčŠ“³ö£© ”£
¢ŚĻņČÜŅŗXÖŠ¼ÓČė×ćĮæĢśŠ¼µÄÄæµÄŹĒ ”£
¢ŪæÉÓĆĮņĖįĖį»ÆµÄ KMnO4ČÜŅŗĶعżµĪ¶Ø·Ø²ā¶ØĀĢ·Æ²śĘ·ÖŠFeSO4ŗ¬Į棬µĪ¶ØŹ±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø4£©ŅŃÖŖFe(OH)3µÄČܶȻż³£ŹżKsp£½1.1”Į10-36”£ŹŅĪĀŹ±ŌŚFeCl3ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗ£¬µ±ČÜŅŗpH=3Ź±£¬Ķعż¼ĘĖćĖµĆ÷Fe3+ŹĒ·ń³ĮµķĶźČ« ”£
£ØĢįŹ¾£ŗµ±Ä³Ąė×ÓÅØ¶ČŠ”ÓŚ1.0”Į10-5 mol•L-1Ź±æÉŅŌČĻĪŖøĆĄė×Ó³ĮµķĶźČ«ĮĖ£©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com