
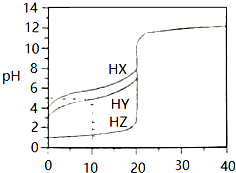
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示,请参考信息完成下列问题:分析 (1)未加OH溶液时,相同浓度的这三种酸,酸的pH越大,说明酸的电离程度越小,酸的酸性越弱;
(2)根据图知,0.1000mol/L的这三种酸,HZ的pH=1、HY和HX的pH都大于1,说明HZ完全电离、HY和HX部分电离,则HX和HY是弱电解质、HZ是强电解质;
若三种酸的pH相同时,酸的电离程度越大其浓度越小,完全中和酸消耗NaOH体积与酸的物质的量成正比.
解答 解:(1)未加OH溶液时,相同浓度的这三种酸,酸的pH越大,说明酸的电离程度越小,酸的酸性越弱,根据图知,0.1000mol/L的这三种酸,HZ的pH=1、HY和HX的pH都大于1,说明HZ完全电离、HY和HX部分电离,则HX和HY是弱电解质、HZ是强电解质,且HY的电离程度大于HX,所以酸性强弱顺序是HZ>HY>HX,
答:这三种酸的强弱顺序是HZ>HY>HX;
(2)根据图知,0.1000mol/L的这三种酸,HZ的pH=1、HY和HX的pH都大于1,说明HZ完全电离、HY和HX部分电离,则HX和HY是弱电解质、HZ是强电解质,则这三种酸与NaOH反应离子方程式分别为HX+OH-=X-+H2O、HY+OH-=Y-+H2O、H++OH-=H2O;
若三种酸的pH相同时,酸的电离程度越大其浓度越小,电离程度HX<HY<HZ,所以相同pH的这三种酸浓度大小顺序是c(HX)>c(HY)>c(HZ),完全中和等体积的这三种酸消耗NaOH体积与酸的物质的量成正比,n(HX)>n(HY)>n(HZ),所以消耗V(NaOH)大小顺序是HX>HY>HZ,
答:离子方程式分别为;HX+OH-=X-+H2O、HY+OH-=Y-+H2O、H++OH-=H2O;消耗V(NaOH)大小顺序是HX>HY>HZ.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确相同浓度的酸的pH与酸电离程度关系是解本题关键,易错点是pH相同酸的浓度大小判断,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
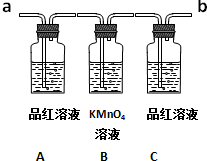 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气与通入冷的消石灰中反应制漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| B. | 向较浓的Na2SiO3溶液中滴加适量盐酸制得硅酸胶体:Na2SiO3+2HCl═2NaCl+H2SiO3(胶体) | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O═Fe3O4+4H2↑ | |
| D. | 用氢氟酸刻蚀玻璃:SiO2+4HF═SiF4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com