
NA代表阿伏加德罗常数,下列叙述正确的是
A.1 mol Cl2在反应中得到电子数不一定为2NA
B.1 mol O2在反应中得到电子数一定为4 NA
C.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
D.在2KClO3+4HC1(浓)==2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物
A
【解析】
试题分析:A、氯气在反应中不一定全部是氧化剂,所以1 mol Cl2在反应中得到电子数不一定为2NA,A正确;B、氧气在反应中不一定得到4个电子,也可能得到2个电子,所以1 mol O2在反应中得到电子数不一定为4 NA,B不正确;C、过氧化钠再与水的反应中氧元素的化合价部分降低到-2价,部分升高到0价,即过氧化钠既是氧化剂,也是还原剂,则1 mo1 Na2O2与足量H2O反应,转移了 NA 个电子,C错误;D、在2KClO3+4HC1(浓)==2KCl+2C1O2↑+C12↑+2H2O中,氯气只是氧化产物,C1O2是还原产物,D错误,答案选A。
考点:考查氧化还原反应的有关判断与计算


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
硫酸、盐酸和硝酸与烧碱和纯碱并称为工业上的“三酸两碱”。下列说法正确的是
A.等质量的铝与足量的烧碱和盐酸反应生成氢气的质量相同
B.等质量的铜与足量的浓硫酸和浓硝酸反应生成气体的物质的量相同
C.相同物质的量的烧碱和纯碱与足量盐酸反应,消耗盐酸的体积相同
D.相同质量的硫与足量烧碱、浓硫酸、浓硝酸反应,转移电子数相同
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:选择题
由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④③⑤① B.③②④①⑤ C.③④②⑤① D.②④⑤③①
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:实验题
(14分)下图是实验室中制备气体或验证气体性质的装置图
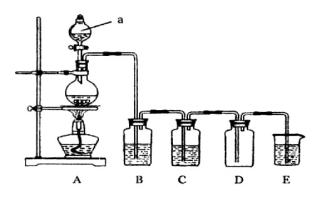
(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
下列描述正确的是
A.氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存
C.某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42-
D.Fe(NO3)2溶液中滴加少量稀硫酸会变黄色
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
将0.02 mol Na别投入到盛有100 mL水、100 mL 1mol/L盐酸、100 mL 1mol/L硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )。
A.三个烧杯中一定均会发生的离子反应有:2Na+2H2O==2Na++2OH—+H2↑
B.三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些
C.Z烧杯中一定会有沉淀生成,但沉淀不是单质铜
D.三个烧杯中生成氢气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三11月阶段模块考试化学试卷(解析版) 题型:填空题
(13分)I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O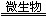 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+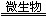 Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+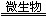 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O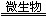 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________ 。在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________ _。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
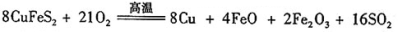
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三11月阶段模块考试化学试卷(解析版) 题型:选择题
下列描述正确的是
A.氯气、SO2都能使品红溶液褪色,它们的漂白原理相同
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存
C.某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42-
D.Fe(NO3)2溶液中滴加少量稀硫酸会变黄色
查看答案和解析>>
科目:高中化学 来源:2015届山东省临沂市高三10月份月考化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应: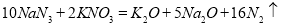 。则下列判断错误的是.
。则下列判断错误的是.
A.该反应能在瞬间完成,并产生大量气体
B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol
C.该反应中的氧化剂为KNO3
D.被氧化和被还原的N原子的物质的量之比为15:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com