
| A. | 1mol O的质量为16g•mol-1 | |
| B. | 1mol He约含有6.02×1023个原子 | |
| C. | 2H既表示2个氢原子,又表示2mol氢原子 | |
| D. | 1mol HCl约含有6.02×1023个原子 |
分析 A.质量的单位为g,g/mol为物质的量的单位;
B.氦气为单原子分子,1mol氦气中约含有6.02×1023个原子;
C.2H只能表示两个氢原子,不表示2mol氢原子;
D.氯化氢为双原子分子,1mol氯化氢分子中含有2mol原子.
解答 解:A.1mol O的质量为16g,故A错误;
B.稀有气体为单原子分子,则1mol He约含有6.02×1023个原子,故B正确;
C.2H既表示2个氢原子,而2mol氢原子应该表示为2molH,故C错误;
D.1molHCl中含有2mol原子,约含有2×6.02×1023个原子,故D错误;
故选B.
点评 本题考查了物质的量的单位-摩尔的表示方法及物质的量的计算,题目难度不大,明确质量与摩尔质量、物质的量与其它物理量之间的关系为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | KI | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(AgI) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、强氧化性 | |
| C | 稀盐酸 | Na2SO3 | KMnO4溶液 | SO2有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加醋酸时:c(OH-)=c(Na+) | |
| B. | 加入10mL醋酸时:c(OH-)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | 加入醋酸至溶液pH=7时:c(CH3COO-)=c(Na+) | |
| D. | 加入20mL醋酸时:2c(OH-)=c(CH3COO-)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁全部变成镁离子时失去的电子数为0.1NA | |
| B. | 1.0 mol任何单质气体的分子数均为NA,原子数均为2NA | |
| C. | 17gNH3所含的电子数目为NA | |
| D. | 16g 02和03混合气体中.含有原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | / | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | / | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
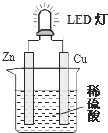 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )| A. | 装置中存在“化学能→电能→光能”的转换 | |
| B. | 铜片上发生的反应为:2H++2e-=H2 | |
| C. | 如果将硫酸换成柠檬汁,导线中不会有电子流动 | |
| D. | 如果将锌片换成铁片,电路中的电流方向不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com