
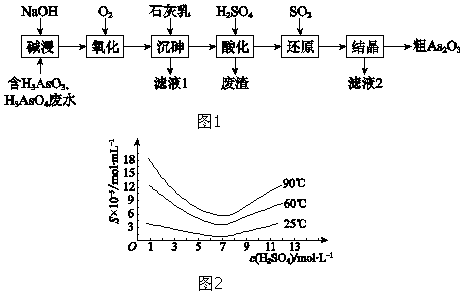
分析 向工业废水(含有H3AsO4、H3AsO3)加入氢氧化钠碱浸:H3AsO4+3NaOH═Na3AsO4+3H2O、H3AsO3+3NaOH═Na3AsO3+3H2O,得到含有Na3AsO4、Na3AsO3的溶液,融入氧气氧化Na3AsO3为Na3AsO4,再加入石灰乳沉砷得到Ca5(AsO4)3OH沉淀,用稀硫酸溶解沉淀,生成H3AsO4和硫酸钙,通入二氧化硫将H3AsO4还原为H3AsO3,反应为:H3AsO4+H2O+SO2═H3AsO3+H2SO4,“还原”后加热溶液,H3AsO3分解为As2O3,调硫酸浓度约为7 mol•L-1,冷却至25℃,过滤,得粗As2O3,据此分析作答.
解答 解:(1)H3AsO4与氢氧化钠反应转化为Na3AsO4反应的化学方程式H3AsO4+3NaOH═Na3AsO4+3H2O;
故答案为:H3AsO4+3NaOH═Na3AsO4+3H2O;
(2)“氧化”时,AsO33-转化为AsO43-,As元素由+3价升高到+5价,转移2个电子,则1mol AsO33-转化为AsO43-转移电子2mol,氧气由0价降到-2价,需要0.5mol;
故答案为:0.5;
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:a.Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0,b.5Ca2++OH-+3AsO43-?Ca5(AsO4)3OH△H>0,温度升高高于85℃后,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降;
故答案为:温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降;
(4)“还原”过程中二氧化硫将H3AsO4还原为H3AsO3,自身被氧化生成硫酸,反应为:H3AsO4+H2O+SO2═H3AsO3+H2SO4;
故答案为:H3AsO4+H2O+SO2═H3AsO3+H2SO4;
(5)由图2可知:硫酸浓度约为7 mol•L-1,25℃时As2O3的沉淀率最大,易于分离,故为了提高粗As2O3的沉淀率,调硫酸浓度约为7 mol•L-1,冷却至25℃,过滤;
故答案为:调硫酸浓度约为7 mol•L-1,冷却至25℃,过滤;
(6)a.钙离子未充分除去,粗As2O3中含有CaSO4,正确;
b.滤液2为硫酸,可循环使用,提高砷的回收率,正确;
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的,正确;
故答案为:abc.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 25℃、101kPa下Na2O(s)+O2(g)═2Na2O2(s)△H=-142kJ/mol | |
| D. | 25℃、101kPa下Na2O2(s)+2Na(g)═2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
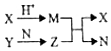 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N>M | B. | 原子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | 图中有两个氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的最高价氧化物的水化物之间不能发生反应 | |
| B. | W、X两种元素形成的简单离子的半径大小顺序:X>W | |
| C. | 元素Q和Z能形成QZ2型的共价化合物 | |
| D. | Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
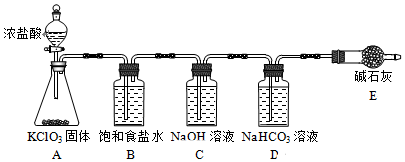
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
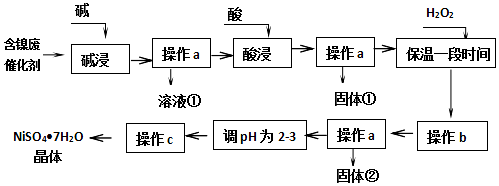
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com