
| A. | 将CO2转化为燃料可减少CO2温室气体的排放 | |
| B. | CO2转化为HCOOH过程是CO2被还原的过程 | |
| C. | 新型电催化材料降低了CO2催化还原的活化能 | |
| D. | 新型电催化材料提高了CO2还原为HCOOH的平衡常数 |
分析 CO2转化为HCOOH可认为是催化加氢,碳元素的化合价从+4价降低为+2价,是还原过程,将CO2回收利用可减少温室气体CO2的排放.催化剂降低反应的活化能,但不能改变化学平衡,不能改变化学平衡常数,以此解答该题.
解答 解:A.二氧化碳为导致温室效应的气体,则将CO2转化为燃料可减少CO2温室气体的排放,故A正确;
B.CO2转化为HCOOH可认为是催化加氢,碳元素的化合价从+4价降低为+2价,是还原过程,故B正确;
C.催化剂降低反应的活化能,加快反应速率,故C正确;
D.催化剂降低反应的活化能,但不能改变化学平衡,不能改变化学平衡常数,故D错误.
故选D.
点评 本题考查较为综合,涉及氧化还原反应、环境保护等知识,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| B. | 0.1mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1pH=4的NaHC2O4溶液:c(H2C2O4)>c(C2O42-) | |
| D. | 向1.0L0.1mol•L-1的醋酸钠溶液中加入1.0L0.1mol•L-1盐酸:c(Na+)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红,则假设一成立,若溶液变红,则假设一不成立 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 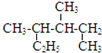 的系统命名是2,3-二甲基戊烷 的系统命名是2,3-二甲基戊烷 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与足量的氢气充分反应后的产物也不是同系物 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I中试剂 | II中试剂 | 目的 | 装置 | |
| A | 澄清石灰水 | 足量酸性KMnO4溶液 | 检验SO2中是否混合有CO2 | 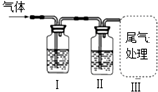 |
| B | 溴水 | NaOH溶液 | 除去CH4中混有的C2H4气体 | |
| C | 饱和Na2CO3溶液 | 浓硫酸 | 除去CO2中混有HCl气体 | |
| D | 澄清石灰水 | CuSO4溶液 | 证明混合气体中含有CO2和H2O气体. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
)是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下: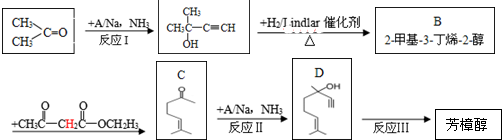
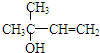 ,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.
,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.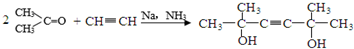 .
. ,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)
,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)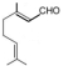 ;芳樟醇在H+作用下也可异构化为香叶醇(
;芳樟醇在H+作用下也可异构化为香叶醇(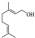 ).下列有关柠檬醛的下列说法正确的是BCD
).下列有关柠檬醛的下列说法正确的是BCD查看答案和解析>>
科目:高中化学 来源: 题型:解答题
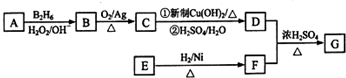
 .
.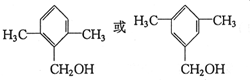 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. )的合成路线:
)的合成路线: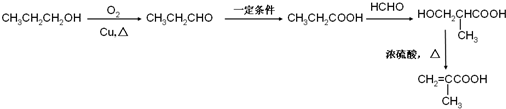 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:R>Z>W | |
| B. | 原子半径:R<W<Y<Z<X | |
| C. | X分别与W、R形成的化合物的化学键类型不一定相同 | |
| D. | 电解X与R形成化合物的溶液可获得X的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com