

| ���� | ��A(����) | B(��Һ) | D(����) | G(��Һ) |
| ��ɫ | ����ɫ | ��ɫ | ����ɫ | dz��ɫ |
| ���� | ��A(����) | B(��Һ) | D(����) | G(��Һ) |
| ��ɫ | ����ɫ | ��ɫ | ����ɫ | dz��ɫ |
| | Fe | FeCl3 | Fe2O3 | FeSO4 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
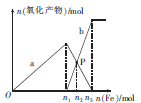
| A��a��ʾFe3+�Ĺ�ϵ���� |
| B��n1=0.75 |
| C��P��ʱ��n��Fe2+��="0.5625" mol |
| D����P����Һ�м���ͭ�ۣ������ܽ�14.4 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��65 ��56 | B��56 ��108 |
| C��56 ��9 | D��65 ��9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 eCO3��ijѧϰС����������ʵ�飺
eCO3��ijѧϰС����������ʵ�飺 ��������ʲô��
��������ʲô���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͨ������ | B������KSCN ��Һ | C������ͭ�� | D���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 �����������ʹ�õĽ���֮һ�����������仯�����֪ʶ������������⡣
�����������ʹ�õĽ���֮һ�����������仯�����֪ʶ������������⡣| A��Fe | B��FeCl3 | C��FeSO4  | D��Fe2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
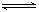 Al(OH)4- + H+ ��NH3+H2O
Al(OH)4- + H+ ��NH3+H2O NH4+ + OH_
NH4+ + OH_�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com