
取一定质量的两种有机物组成的混合物,无论以何种比例混合,在足量的氧气中充分燃烧后生成的CO2和H2O的量总是相同的,则此混合物是
A.甲烷和丙烷 B.乙烯和丙烷
C.甲醛和乙酸 D.乙醇和丙醇
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:阅读理解
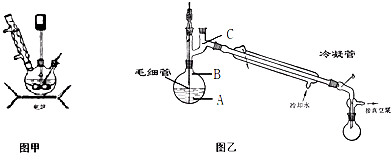
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途. 用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→H2N-NH2?H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途. 用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→H2N-NH2?H2O+NaCl+Na2CO3.查看答案和解析>>
科目:高中化学 来源:2013届江苏省南京学大教育专修学校高三4月月考化学试卷(带解析) 题型:实验题
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途。用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO +NaClO+2NaOH → H2N—NH2·H2O+NaCl+Na2CO3。
主要副反应:N2H4+2NaClO= N2↑+2H2O+2NaCl △H<0
3NaClO=" 2NaCl" +NaClO3 △H>0
CO(NH2)2 +2NaOH= 2NH3↑+Na2CO3 △H>0
【深度氧化】:(NH2)2CO+3NaClO= N2↑+3NaCl+CO2↑+2H2O △H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2。
步骤2.静置后取上层清液,检测NaClO的浓度。
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤4.称取一定质量尿素配成溶液,置于冰水浴。将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h。
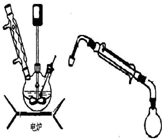
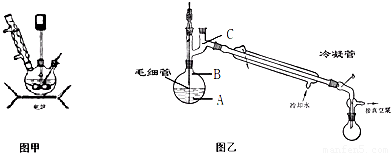
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5 min。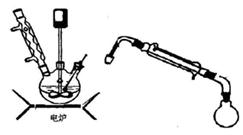
步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品。
(1)步骤1温度需要在30℃以下,其主要目的是 。
(2)步骤2检测NaClO浓度的目的是 。
a.确定步骤3中需NaClO溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应 (选填:“放热”或“吸热”)。
(4)步骤5必须急速升温,严格控制回流时间,其目的是 。
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI)。测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液。
b.移取l0.00 mL于锥形瓶中,加入20mL水,摇匀.
c.用0.l000 mol/L碘溶液滴定至溶液出现微黄色且Imin内不消失,计录消耗碘的标准液的体积。
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”)。
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为 。
③为获得更可靠的滴定结果,步骤d中进一步操作主要是:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三4月月考化学试卷(解析版) 题型:实验题
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途。用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO +NaClO+2NaOH → H2N—NH2·H2O+NaCl+Na2CO3。
主要副反应:N2H4+2NaClO= N2↑+2H2O+2NaCl △H<0
3NaClO=" 2NaCl" +NaClO3 △H>0
CO(NH2)2 +2NaOH= 2NH3↑+Na2CO3 △H>0
【深度氧化】:(NH2)2CO+3NaClO= N2↑+3NaCl+CO2↑+2H2O △H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2。
步骤2.静置后取上层清液,检测NaClO的浓度。
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤4.称取一定质量尿素配成溶液,置于冰水浴。将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h。
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5 min。
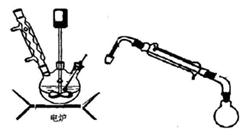
步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品。
(1)步骤1温度需要在30℃以下,其主要目的是 。
(2)步骤2检测NaClO浓度的目的是 。
a.确定步骤3中需NaClO溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应 (选填:“放热”或“吸热”)。
(4)步骤5必须急速升温,严格控制回流时间,其目的是 。
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI)。测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液。
b.移取l0.00 mL于锥形瓶中,加入20mL水,摇匀.
c.用0.l000 mol/L碘溶液滴定至溶液出现微黄色且Imin内不消失,计录消耗碘的标准液的体积。
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”)。
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为 。
③为获得更可靠的滴定结果,步骤d中进一步操作主要是:
查看答案和解析>>
科目:高中化学 来源:2013年浙江省湖州市高考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com