

分析 (1)A是短周期中原子半径最大的元素构成的单质,应为Na,E既可溶于盐酸又可溶于NaOH溶液,应为Al(OH)3,工业冶炼Na用电解熔融的NaCl的方法;
(2)若A为红色金属为Cu,B 为某酸的浓溶液,C 为可形成酸雨的无色气体为二氧化硫,则A 与B反应为铜和浓硫酸加热的反应;
(3)既含有极性键又含有非极性键的四原子分子有C2H2或H2O2,其中能燃烧的是C2H2,则A为CaC2,与水反应生成C2H2和Ca(OH)2,与B的溶液反应生成C2H2、水和碳酸钙,则B为Ca(HCO3)2,0.1molC 完全燃烧生成液态水时放热130kJ•mol-1,1molC2H2完全燃烧生成液态水时放热1300kJ,则2molC2H2完全燃烧放出2600kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式.
解答 解:(1)A是短周期中原子半径最大的元素构成的单质,应为Na,E既可溶于盐酸又可溶于NaOH溶液,应为Al(OH)3,
Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,工业冶炼Na用电解熔融的NaCl的方法,反应的化学方程式为2NaCl(熔融) $\frac{\underline{\;通电\;}}{\;}$2 Na+Cl2↑,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;2NaCl(熔融) $\frac{\underline{\;通电\;}}{\;}$2 Na+Cl2↑;
(2)若A为红色金属为Cu,B 为某酸的浓溶液,C 为可形成酸雨的无色气体为二氧化硫,则A 与B反应为铜和浓硫酸加热的反应,
反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)既含有极性键又含有非极性键的四原子分子有C2H2或H2O2,其中能燃烧的是C2H2,则A为CaC2,与水反应生成C2H2和Ca(OH)2,与B的溶液反应生成C2H2、水和碳酸钙,则B为Ca(HCO3)2,
0.1molC 完全燃烧生成液态水时放热130kJ•mol-1,1molC2H2完全燃烧生成液态水时放热1300kJ,则2molC2H2完全燃烧放出2600kJ的热量,
所以完全燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1,
故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1.
点评 本题考查无机物的推断、物质性质分析,题目难度中等,本题注意既含有极性键又含有非极性键的四原子分子有C2H2或H2O2,其中能燃烧的是C2H2,注意热化学方程式的书写.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在试管a中先加入2mL 95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
在试管a中先加入2mL 95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | |
| A | 滴入淀粉溶液 | 溶液变蓝色 |
| B | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| C | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| D | 滴入KSCN溶液 | 溶液变红色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
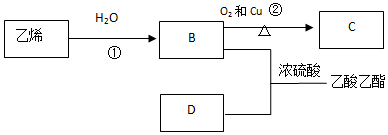
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C.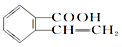 D.
D.
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com