
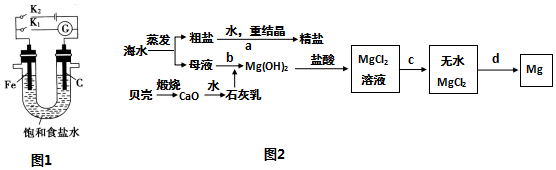
分析 (1)①仅K1闭合,为原电池,铁发生吸氧腐蚀,石墨电极氧气得到电子发生还原反应;
②仅K2闭合,为电解池,铁为阴极,石墨为阳极,电解氯化钠溶液生成氢氧化钠、氯气和氢气,铁棒上水电离产生的氢离子得到电子发生还原反应生成氢气,促进了水的电离平衡正向移动,导致c(H+)<c(OH-);
③仅K2闭合,为电解池,铁为阴极,石墨为阳极,电解氯化钠溶液生成氢氧化钠、氯气和氢气;
(2)①在溶解操作中,玻璃棒起到搅拌以加快粗盐的溶解的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒起到搅拌而使液体受热均匀的作用;
②使c(Mg2+)×c2(OH-)≤Ksp,镁离子沉淀完全;
③氯化镁水解生成氢氧化镁和氯化氢;
④电解无水氯化镁生成镁单质与氯气.
解答 解:(1)①仅K1闭合,为原电池,铁发生吸氧腐蚀,石墨电极氧气得到电子发生还原反应,电极反应式:O2+4e-+2H2O=4OH-;
故答案为:O2+4e-+2H2O=4OH-;
②仅K2闭合,为电解池,铁为阴极,石墨为阳极,电解氯化钠溶液生成氢氧化钠、氯气和氢气,铁棒上水电离产生的氢离子得到电子发生还原反应生成氢气,H2O?H++OH-,由于2H++2 e-=H2↑,使平衡正向移动,结果c(H+)<c(OH-),所以在铁棒附近滴加酚酞显红色;
故答案为:H2O?H++OH-,由于2H++2 e-=H2↑,使平衡正向移动,结果c(H+)<c(OH-);
③仅K2闭合,为电解池,铁为阴极,石墨为阳极,电解氯化钠溶液生成氢氧化钠、氯气和氢气,离子方程式:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-
;
故答案为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(2)①粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程).在溶解、过滤、蒸发操作中都要用到的玻璃仪器是玻璃棒,在溶解操作中,玻璃棒起到搅拌以加快粗盐的溶解的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒起到搅拌而使液体受热均匀的作用;
故答案为:玻璃棒;
②为使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10-5mol•L-1时,沉淀就达完全),则应满足:10-5mol•L-1×C2(OH-)≤1×10-11,
解得:C(OH-)=10-3mol/L,则氢离子浓度为:$\frac{10{\;}^{-14}}{10{\;}^{-3}}$=10-11(mol/L),pH=11;
故答案为:11;
③氯化镁水解生成氢氧化镁和氯化氢,方程式:MgCl2+2H2O?Mg(OH)2↓+2HCl↑,加热氯化氢挥发,促进平衡正向移动,所以得到的为氢氧化镁沉淀,在氯化氢氛围中可以抑制氯化镁水解而得到氯化镁;
故答案为:MgCl2+2H2O?Mg(OH)2↓+2HCl↑;
④电解无水氯化镁生成镁单质与氯气,电解方程式:MgCl2 (熔融) $\frac{\underline{\;电解\;}}{\;}$ Mg+Cl2↑;
故答案为:MgCl2 (熔融) $\frac{\underline{\;电解\;}}{\;}$ Mg+Cl2↑.
点评 本题为综合题,考查了电解池、原电池、盐类水解及化学平衡移动,明确电解池、原电池工作原理及电极方程式的书写,熟悉盐类水解的性质及影响盐类水解的因素是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 往碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向盛有1mLmol/LMgCl2溶液的试管中滴加1-2滴2mol/LNaOH溶液,有白色沉淀产生,再滴加2滴0.1mol/LFeCl3溶液,白色沉淀转变为红褐色 | |
| C. | 重铬酸钾酸性溶液中加入乙醇,溶液由墨绿色变为橙黄色 | |
| D. | 用石墨作电极电解CuCl2溶液可观察到阳极石墨棒上覆盖一层红色的铜,阴极石墨棒上生成能使湿润碘化钾淀粉试纸变蓝的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y>X>W | |
| B. | Z与W形成的化合物中存在共价键 | |
| C. | 一定条件下Z3Y2与水反应可生成M | |
| D. | 工业上用W单质与澄清石灰水反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
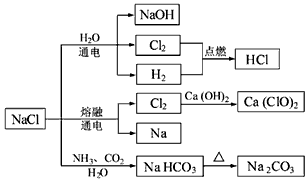
| A. | 石灰乳与Cl2的反应中,Cl2既作氧化剂,又作还原剂 | |
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| C. | 图示的转化反应中有3个分解反应 | |
| D. | 图示的转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 | |
| C. | 石英玻璃耐强酸强碱,高温下可用来熔融氢氧化钠 | |
| D. | Na2SiO3是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com