
分析 (1)pH相同溶液中氢离子浓度相同,依据醋酸是弱酸,盐酸是一元强酸、硫酸是二元强酸分析判断;
(2)pH=-lgc(H+),溶液pH大小由溶液中氢离子浓度大小分析计算判断;
(3)中和等量氢氧化钠,依据化学方程式中的电离关系计算判断;
(4)根据硫酸和盐酸为强酸,溶液中完全电离,醋酸为弱电解质,溶液中部分电离分析;
(5)开始时的反应速率由氢离子浓度决定,随着氢离子浓度的减小,醋酸电离平衡正向移动,因此同一时刻醋酸溶液中氢离子浓度最大,盐酸和硫酸溶液中氢离子浓度相等;
(6)稀释10倍,强酸溶液的pH增加1个单位,弱酸增大不到一个单位.
解答 解(1)当它们pH相同时,溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L;需要②溶液浓度为1mol/L;需要③H2SO4 溶液浓度为0.5mol/L;其物质的量浓度由大到小排列的是①>②>③,
故答案为:①>②>③;
(2)当它们的物质的量浓度相同时,CH3COOH是弱酸部分电离,氢离子浓度最小;HCl是强酸完全电离,电离的氢离子大于醋酸;H2SO4是二元强酸,电离的氢离子浓度大于氯化氢,根据pH=-lgc(H+)可知,溶液的pH由大到小排列的是:③<②<①,
故答案为:③<②<①;
(3)中和等量的烧碱溶液,假设氢氧化钠物质的量为1mol,需要①醋酸1mol,需要②HCl1mol,需要③H2SO40.5mol,需同浓度的三种酸溶液的体积大小关系为①=②>③,
故答案为:①=②>③;
(4)当它们的pH相同体积相同时,同时加入足量锌,硫酸和盐酸为强酸,pH相同,溶液中氢离子浓度相等,二者与锌反应生成氢气相等,而醋酸溶液中氢离子浓度减小,醋酸的电离程度增大,因此醋酸溶液中产生氢气最多,所以产生氢气的体积关系为:①>②=③,
故答案为:①>②=③;
(5)刚开始时pH相同说明氢离子浓度相同,反应速率相等,即为①=②=③;随着氢离子浓度的减小,醋酸电离平衡正向移动,因此同一时刻醋酸溶液中氢离子浓度最大,盐酸和硫酸溶液中氢离子浓度相等,氢离子浓度越大,反应速率越快,产生相同体积的气体所用时间越少,即①<②=③,
故答案为:①=②=③;①<②=③;
(6)稀释10倍,强酸溶液的pH增加1个单位,弱酸增大不到一个单位,因此pH大小关系是①<②=③,
故答案为:①<②=③.
点评 本题考查了弱电解质的电离,会分析等物质的量浓度的不同酸时溶液 pH的相对大小,等pH时不同酸溶液的物质的量浓度相对大小,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
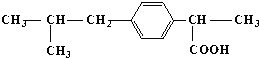
| A. | ③⑤ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:
草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
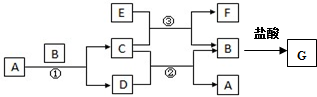
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:b<c | |
| B. | 最高价氧化物对应水化物的酸性:b>d | |
| C. | 单质沸点:d>c | |
| D. | a、b、c不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | 在pH=2的溶液中:NH4+、K+、ClO-、Cl- | |
| C. | 在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、C1O-、NO3- | |
| D. | 水电离c(H+)=10-12的溶液中:Mg2+、Cu2+、SO42+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com