
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为___________________________。在元素周期表中,该元素在________(填“s”“p”“d”“f”或“ds”)区。与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有__________种。
②CO32-的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为___________________________________。
②CO2分子中C原子轨道的杂化类型为________________________________________。
③1 mol甲醛(HCHO)分子中含有的σ键数目为__________________________________。
【答案】3d54s2 d 2 平面三角形 C≡O sp 3 NA
【解析】
(1)①Mn原子核外电子数为25,基态原子的电子排布式为:1s22s22p63s23p63d54s2,价电子电子排布式可为3d54s2;在元素周期表中,该元素在d区;与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有Cr、Cu均为4s1,共2种;
②CO32-中C原子价层电子对数为3+![]() =3、没有孤对电子,其空间构型为平面三角形;
=3、没有孤对电子,其空间构型为平面三角形;
(2)①CO与N2互为等电子体,二者结构相似,CO分子中原子之间形成三键,故其结构式为C≡O;
②CO2的结构式为O=C=O,C原子形成2个σ键,没有孤对电子,杂化轨道数目为2,采取sp杂化;
③甲醛的结构式为![]() ,单键为σ键,双键含有1个σ键、1个π键,分子含有3个σ键,1 mol甲醛(HCHO)分子中所含σ键的数目为3 NA。
,单键为σ键,双键含有1个σ键、1个π键,分子含有3个σ键,1 mol甲醛(HCHO)分子中所含σ键的数目为3 NA。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】二甲醚(![]() )是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① |
|
|
② |
|
|
③ |
|
|
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 |
|
| C≡O | H-O | C-H |
| 436 | p>343 | 1076 | 465 | 413 |
由上述数据计算![]() __________________________________;
__________________________________;
(2)该工艺的总反应为![]() ,该反应
,该反应![]() _______________,化学平衡常数
_______________,化学平衡常数![]() ______________________(用含
______________________(用含![]() 的代数式表示);
的代数式表示);
(3)下列措施中,能提高![]() 产率的有______________________________;
产率的有______________________________;
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了![]() 的产率,原因是___________________________。
的产率,原因是___________________________。
(5)以![]() 通入
通入![]() 的反应器中,一定条件下发生反应:
的反应器中,一定条件下发生反应: ![]() ,其
,其![]() 的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是____________________;
的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是____________________;
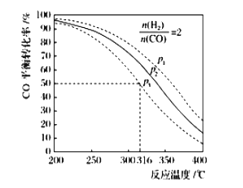
A.该反应的![]()
B.若在![]() 和
和![]() 时反应达到平衡,则CO的转化率小于50%
时反应达到平衡,则CO的转化率小于50%
C.若在![]() 和
和![]() 时反应达到平衡, 氢气的转化率等于50%
时反应达到平衡, 氢气的转化率等于50%
D.若在![]() 和
和![]() 时,起始时
时,起始时![]() ,则达平衡时CO的转化率大于50%
,则达平衡时CO的转化率大于50%
E.若在![]() 和
和![]() 时,反应达平衡后保持温度和压强不变,再充入
时,反应达平衡后保持温度和压强不变,再充入![]() 和
和![]() ,则平衡时二甲醚的体积分数增大
,则平衡时二甲醚的体积分数增大
(6)某温度下,将![]() 和
和![]() 充入容积为
充入容积为![]() 的密闭容器中,发生反应:
的密闭容器中,发生反应:![]() ,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数
,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数![]() ____________________________。
____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现白蚁信息素有:![]() (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),![]() (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列说法不正确的是
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列说法不正确的是
A.2,4-二甲基1庚烯的分子式为C9H18
B.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物
C.以上三种信息素均能使溴的四氯化碳溶液褪色
D.1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置可用来测定含两种元素的某种气体 X 的分子式。

在注射器A中装有240mL气体 X 慢慢通过不含空气并装有红热的氧化铜的玻璃 管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由______(填元素符号)元素组成的。
(2)若240mLX气体完全反应后,收集到的氮气质量是0.28g。根据实验时温度和压强计算 1molX气体的体积是24000mL,则X的摩尔质量是______。
(3)通过计算确定X的分子式为________。
(4)写出B中发生反应的化学方程式__________。(X在该条件下不发生分解反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,向20 mL 0.1 mol·L1ROH溶液中滴加0.1 mol·L1盐酸,混合溶液的pH与盐酸体积的关系如图所示。已知298 K时ROH的电离度为1.37%,lg 1.37≈0.1。下列说法正确的是
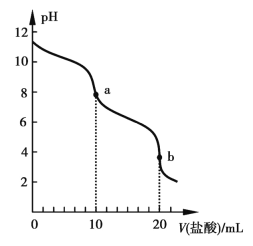
A. 水的电离程度:a>b
B. pH=7时,溶液中c(R+)=c(Cl)=c(H+)=c(OH)
C. b点溶液中存在c(C![]() )>c(R+)>c(OH)>c(H+)
)>c(R+)>c(OH)>c(H+)
D. 298 K时0.1 mol·L1ROH溶液的pH≈11.1
查看答案和解析>>
科目:高中化学 来源: 题型:
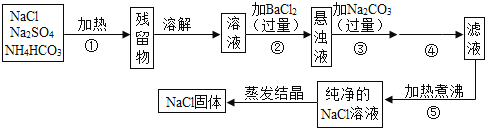
【题目】为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
试回答下列问题:
(1)操作①的目的是_______。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是_______。
(3)写出操作③有关的化学反应方程式_______。操作④的名称是_______。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaClm1g,最后得到的NaCl固体m2g,则m1_______m2(填“>”、“<”或“﹦”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
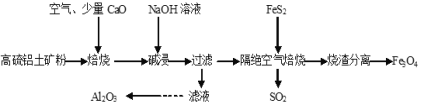
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:

(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
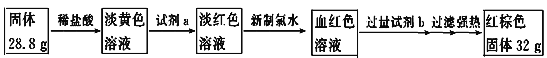
化合物甲的质量分数为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com