
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做l题。若两题都作答,则以A题计分。
A《化学与生活》
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是______(填字母)。
a.二氧化碳的浓度 b.二氧化硫的浓度 c.可吸入颗粒物的浓度
②下列做法中不利于改善环境质量的是______(填字母)。
a.将废旧电池进行深埋处理
b.充分利用风能等新能源
c.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是______(填字母)。
a.氧化还原法 b.中和法 c.沉淀法
④煤炭直接燃烧引起多种环境问题。燃煤产生的SO2增加了______形成的可能;处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,发生反应的化学方程式为_____________________。
(2)合理应用化学知识可以更好地认识生活、改善生活。
①等质量的糖类、油脂、蛋白质中,提供能量最多的是______。蛋白质水解可以得到______。
②人体牙龈出血、患坏血病的原因主要是因为缺乏______(填“维生素A”、“维生素C”或“维生素D”)。
(3)性能各异的各种材料的广泛应用大大提高了人们的生活水平。试回答问题:

①石墨烯(见图)可用作太阳能电池的电极,这里主要利用了石墨烯的______性。
②高炉炼铁和生产硅酸盐水泥都要用到的原料是______(填字母)。
a. 黏土 b. 石灰石 c. 焦炭
③“神七”国产“飞天”舱外服由六层组成。从内到外依次为由特殊防静电处理过的棉布组成的舒适层、合成橡胶质地的备份气密层、复合材料结构组成的主气密层、涤纶面料的限制层、隔热层和最外防护层。其中由天然有机高分子材料组成的层是______(填字母)。
a. 舒适层 b. 备份气密层 c. 主气密层
④材料与化学密切相关,表中对应关系正确的是______(填字母)。
选项 | 材料 | 主要化学成分 |
a | 刚玉、金刚石 | 三氧化二铝 |
b | 大理石、石灰石 | 碳酸钙 |
c | 光导纤维、普通玻璃 | 硅酸盐 |
⑤铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用盐酸除去,写出该反应的化学方程式________________________________。
B《有机化学基础》
(1)认识有机化合物的结构与类别有助于理解其性质。
①下列有机化合物与苯甲酸(C6H5COOH)互为同系物的是______(填字母,下同)。
a. C6H5CH2COOH b. C6H5CH2CHO c. C6H5OH
②下列有机化合物易溶于水的是______。
a. 苯 b. 乙烷 c. 乙醇
③下列试剂可用于鉴别乙酸和乙醛的是______。
a. 水 b. 银氨溶液 c. 稀硫酸
(2)扁桃酸(C6H5CHOHCOOH)是一种重要的化工原料。
①扁桃酸分子中有______种不同化学环境的氢。
②扁桃酸中含氧官能团的名称为______和______。
③1 mol扁桃酸最多能与______mol金属钠反应
(3)化合物C是一种医药中间体,可通过下列方法合成:
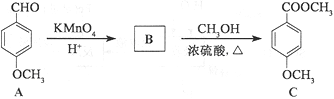
①A中含氧官能团的名称为______和______。
②B的结构简式为______。
③B→C的反应类型为______。
④C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应,且1molD最多能与2molNaOH反应。D分子中有4种不同化学环境的氢,请写出D的一种结构简式:______。
【答案】a a b (硫酸型)酸雨 2CO+SO2![]() 2CO2+S 油脂 氨基酸 维生素C 导电 b a b Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O a c b 6 羟基 羧基 2 醛基 醚键
2CO2+S 油脂 氨基酸 维生素C 导电 b a b Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O a c b 6 羟基 羧基 2 醛基 醚键  取代反应或酯化反应
取代反应或酯化反应 
【解析】
A《化学与生活》
(1)①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,二氧化碳的浓度不需要检测,故答案选a;
②a.废旧电池中含有重金属,进行深埋处理能污染水资源和土壤,应回收处理,故a错误;
b.充分利用太阳能等清洁能源,减少了化石燃料的使用,有利于改善环境质量,故b正确;
c.给汽车加装尾气催化净化装置,减少了污染物一氧化碳和一氧化氮的排放,有利于改善环境质量,故c正确;
故答案选a;
③废水中含有盐酸,盐酸易溶于水,盐酸溶液呈酸性,所以要在废水中加入碱性物质,使其发生酸碱中和反应而降低废水的酸性,所以采用的处理方法是中和法,故答案选b;
④二氧化硫容易引起酸雨,则燃煤产生的SO2增加了硫酸型酸雨形成的可能;处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,硫元素化合价降低,则碳元素化合价升高,因此还有二氧化碳生成,则发生反应的化学方程式为2CO+SO2![]() 2CO2+S。
2CO2+S。
(2)①每克脂肪在人体内氧化分解产生约为37.6kJ的热量,葡萄糖约为16.4kJ,蛋白质约为16.7kJ,提供能量最多的是油脂,蛋白质水解最终生成氨基酸。
②人体牙龈出血、患坏血病的原因主要是因为缺乏维生素C。
(3)①石墨烯具有十分良好的强度、柔韧、导电、导热、光学特性能,作电极是利用了石墨烯的导电性。
②生产硅酸盐水泥用到黏土和石灰石,高炉炼铁用到焦炭、石灰石等,都用到石灰石,故高炉炼铁和生产硅酸盐水泥都要用到的原料是石灰石,答案为b;
③没经过人工合成加工能直接从自然界获取的高分子材料叫天然高分子材料,则
a、舒适层是由棉布组成的,属于天然高分子材料,故a适合;
b、合成橡胶属于合成有机高分子材料,故b不适合;
c、复合材料结构组成的主气密层属于复合材料,故c不适合;
故答案选a;
④a、刚玉、金刚石的主要成分分别是氧化铝和碳,a不选;
b、大理石、石灰石的主要成分是碳酸钙,b选;
c、光导纤维、普通玻璃的主要成分分别是二氧化硅和硅酸盐,c不选。
答案选b。
⑤铜绿与盐酸反应生成氯化铁、二氧化碳和水,反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O。
B《有机化学基础》
(1)①结构相似,在分子组成上相差一个或若干个CH2原子团的同一类有机物互称为同系物。苯甲酸含有苯基和羧基,则与苯甲酸互为同系物的是苯乙酸(C6H5CH2COOH),答案选a;
②苯和乙烷难溶于水,乙醇与水互溶,则有机化合物易溶于水的是乙醇,答案选c;
③a. 乙酸和乙醛均与水互溶,不能用水鉴别,a错误;
b. 乙酸不能发生银镜反应,乙醛能发生银镜反应,可以用银氨溶液鉴别乙酸和乙醛,b正确;
c. 稀硫酸与二者均不反应,不能鉴别乙酸和乙醛,c错误;
答案选b;
(2)①扁桃酸的结构简式为C6H5CHOHCOOH,则分子中有6种不同化学环境的氢。
②根据扁桃酸的结构简式可知分子中含氧官能团的名称为羟基和羧基。
③羟基和羧基均与金属钠反应,则1 mol扁桃酸最多能与2mol金属钠反应
(3)①根据A的结构简式可知分子中含氧官能团的名称为醛基和醚键。
②A在酸性高锰酸钾的作用下醛基被氧化为羧基,则B的结构简式为 。
。
③B→C是羧基与甲醇中的羟基发生酯化反应,反应类型为取代反应或酯化反应。
④C的同分异构体D能发生银镜反应,说明含有醛基,能与FeCl3溶液发生显色反应,说明含有酚羟基。1molD最多能与2molNaOH反应,说明含有2个酚羟基,又因为D分子中有4种不同化学环境的氢,说明苯环上含有2个甲基、2个酚羟基和1个醛基,则符合条件的D一种结构简式为 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】4.35克二氧化锰与50mL12mol/L浓盐酸反应生成标准状况下氯气______升?将反应后所得的溶液稀释至1L,从中取出25mL,加足量的硝酸银溶液,可得沉淀_______克?(MnO2+4HCl![]() MnCl2++Cl2↑+2H2O)
MnCl2++Cl2↑+2H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓ +3H+
B.向氯化钙溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓ +2H+
C.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH--=CaCO3↓ +H2O
D.金属镁与稀盐酸反应:Mg+2H++2Cl-=MgCl2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氯气通入含Fe2+、I-、Br-的溶液,溶液中四种粒子的物质的量的变化如图所示。已知b=a+5,线段Ⅳ表示一种含氧酸,且线段I和Ⅳ表示的物质中含有相同的元素。下列说法错误的是

A. 线段I表示I-的变化情况
B. a点时消耗Cl2的体积为134.4 L
C. 原溶液中n(Fe2+):n(Br-) =2:3
D. 线段Ⅳ表明氧化性:C12>HIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分FeS2)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如下图所示。

下列有关说法不正确的是
A. 经氧化后的黄铁矿可能呈现与铁锈类似的红褐色
B. a步反应中每生成1 mol FeSO4转移电子的物质的量为7 mol
C. 氧化过程会产生较多酸性废水破坏矿区生态环境
D. 标准状况下,0.1 mol FeS2完全被氧化时大约消耗空气40 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装___,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___、___接___、___接___。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____。
②步骤3中加氨水后反应的离子方程式为______________。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
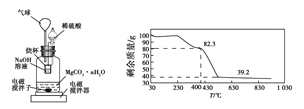
③图中气球的作用是__________________。
④上述反应后期要升温到30 ℃,主要目的是________________。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___(用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1×10-10,Ksp(AgI)=1×10-16,Ksp(Ag2CrO4)=8.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )
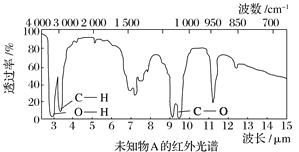
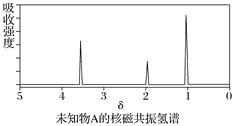
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程如图:
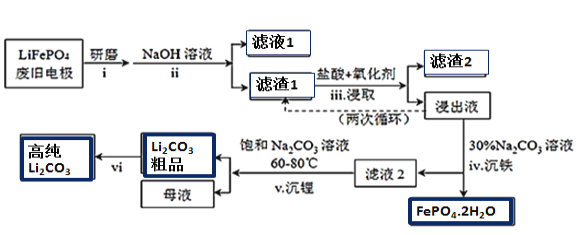
资料:碳酸锂在水中溶解度随温度变化如下:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是__________________。
(2)过程ii加入足量NaOH溶液的作用(用化学反应方程式表示)_________________。
(3)如过程iii采用NaClO3作为氧化剂,则过程中会反应会发生副反应生成黄绿色气体,
①该副反应对应的离子方程式为_______________________________________________________;
从环保角度分析,选择___________(填字母)作为该过程的氧化剂会更好。
a.H2O2 b.浓硫酸 c.浓HNO3
②过程iii得到的浸出液循环两次的目的是________________________________________________。
(4)浸出液中存在大量H2PO4﹣和HPO42-,已知:![]() ,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
(5)简述过程vi的操作______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com