
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ、(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:___________。
Ⅱ、利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、_______、______,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为____________________________。
(5)已知C中是硅酸钠溶液,如要证明非金属性:C > Si,请选择相应的试剂,则A中加________、B中加________。
【答案】 钾 铝 不合理 用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3·H2O不是N元素最高价氧化物对应的水化物 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S S2-+Cl2= S↓+2Cl- 硫酸 Na2CO3 溶液
【解析】Ⅰ、(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,在金属活动顺序中越排在前面的金属越活泼,与相同的酸反应的速率越快,所以与盐酸反应最快的金属是钾;在金属活动顺序中越排在后面的金属越不活泼,与相同的酸反应的速率越慢,所以与盐酸反应最慢的金属是铝; (2)用氢氧化钠和氨水碱性强弱比较Na和N的金属性强弱不合理,因为用碱性比较金属性强弱,必须要用最高价氧化物对应水化物的碱性强弱来比较,答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,氨水不是N元素的最高价氧化物对应水化物;Ⅱ、(3)设计实验证明非金属性:Cl>S,利用氯气和Na2S氧化还原反应可以验证,仪器A的名称为分液漏斗,干燥管D的作用是防止倒吸;(4)装置A、B、C中所装药品分别为浓盐酸、MnO2、Na2S溶液,装置C中的现象为有淡黄色沉淀生成,说明Cl2氧化Na2S生成了S,离子方程式为:S2-+Cl2=S↓+2Cl-;(4)若要证明非金属性:S>C>Si,则A中加浓硫酸,B中加Na2CO3,C中加Na2SiO3,硫酸和碳酸钠反应生成CO2,再将生成的CO2通入C中CO2、水和硅酸钠反应生成硅酸,反应的离子方程式为:CO2+H2O+SiO32-=H2SiO3+CO32-,证明酸性硫酸>碳酸>硅酸。


科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、油脂和蛋白质的性质说法正确的是( )
A. 糖类物质中含C、H、O元素,都有甜味
B. 向淀粉溶液中加入碘水,溶液变蓝
C. 油脂是高分子化合物,热值较大
D. 在蛋白质溶液中加入浓硫酸并微热,可使蛋白质变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是( )。

A. 用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝
B. 足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CCl4的沸点低于SiCl4,其原因是晶体类型不同
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是共价化合物
C. HClO易分解是因为HClO分子间作用力弱
D. 离子化合物中不一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。酒精喷灯可用作高温热源。正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。请回答下列问题:
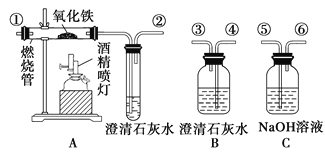
(1)连接装置导管口的顺序:混合气体→__________________→尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是__________________________________;
证明CO存在的有关反应的化学方程式是__________________________________________。
(3)有同学提出仪器B应再使用一次,你认为有道理吗?________(填“有”或“没有”),并简述理由:
_________________________________________________________________。
(4)本实验尾气处理的方法是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)浓盐酸中HCl的物质的量浓度为______________mol·L-1 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少 而变化的是(_______)。
A、溶液中HCl的物质的量 B、溶液的浓度
C、溶液中Cl-的数目 D、溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL 物质的量浓度为0.400mol·L-1的稀盐酸。
①学生需要量取_______mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I、定容时俯视观察凹液面(________)
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(________)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有18000公里的大陆海岸线,海洋资源丰富,品种繁多。
(1)工业上利用海水制取溴单质,一般先用空气或水蒸气吹出卤水中的单质溴,再用SO2将其还原吸收。某研究性学习小组模拟上述过程提取溴,其装置如图所示:

①所用仪器的接口连接顺序是d→__________,e→b_______→f。
②A中发生反应的化学方程式为_____________________________________。
③溶液Z是______________________;C中仪器名称为______________________。
④你认为本实验的不足之处是____________________________________。
(2)某小组测定含溴卤水中溴元素的总量。
①该小组设计的实验方案:上述操作完成后,取C中溶液15.0 mL,加入适量HNO3溶液酸化,再加入足量AgNO3溶液,过滤,测定产生沉淀的质量。此方案不可行的主要原因是_________________(不考虑实验装置及操作失误的原因);
②请为该小组设计一个可行的实验方案_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质变化的比较中,正确的是
A. 酸性强弱HIO4<HBrO4<HClO4 B. 原子半径大小S>Na>O
C. 碱性强弱KOH<NaOH<LiOH D. 金属性强弱Na<Mg<Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com