
分析 (1)含元素的化合价既能升高,又能降低的物质;
(2)胶体的粒子大小范围是:1~100;
(3)FeCl3溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+; 滴入KSCN溶液呈红色,存在三价铁离子;沉淀43.05g是氯化银,物质的量是0.3mol,据此计算氯离子的物质的浓度;
(4)验证该溶液中含有Fe2+,利用其还原性,注意排除铁离子对亚铁离子检验的干扰;
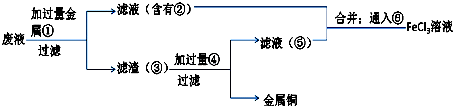
(5)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,以此解答该题.
解答 解:(1)亚铁离子既能被氧化,又能被还原,故C正确,故选C;
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,形成了胶体,胶体粒子直径范围是1~100nm,故答案为:1~100;
(3)FeCl3溶液与铜反应的离子方程式是:2Fe3++Cu═2Fe2++Cu2+;由于滴入KSCN溶液呈红色,证明溶液中Fe3+有剩余,溶液中含有的金属阳离子是:Fe3+Fe2+Cu2+;
43.05g沉淀是氯化银,物质的量为0.3mol,溶液中c(Cl-)=$\frac{0.3mol}{0.05L}$=6.0mol/L;
故答案为:2Fe3++Cu═2Fe2++Cu2+;Fe3+、Fe2+、Cu2+;6.0;
(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,故A错误;
B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+,故B正确;
C、试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有亚铁离子,故C错误;
故选B;
(5)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,
A、由上述分析可知,①为Fe,②为FeCl2③为Fe、Cu,④为HCl,故答案为:Fe;FeCl2;Fe、Cu;HCl;
B、⑥是将亚铁离子氧化成三价铁离子,反应方程式是:2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
点评 本题考查了铁及其化合物的性质,涉及的内容较多,注意分析题中提供的信息,根据所学知识写成反应的方程式,本题难度中等.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 生活中常用到的纯碱、酒精、食醋等,因都含有碳元素,所以都是有机物 | |
| B. | 有的钻戒中的钻石,是金刚石,因有正四面体的网状结构,所以硬度很大 | |
| C. | 由于啤酒中酒精含量不高,因此可以大量饮用,不会醉酒 | |
| D. | 我们用到的蔗糖、淀粉、纤维素,都是由C、H、O元素组成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等物质的量的二氧化硫和一氧化碳所含的分子数一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.8g | B. | 22.4g | C. | 21g | D. | 19.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内消耗amolA和同时生成3amolC | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com