
| A. | 标准状况下,向0.1mol•L -1的醋酸溶液中加入醋酸钠晶体,若混合液的pH=7,则该溶液中c(Na+)>c(CH3COO-) | |||||||||||
| B. | 根据下表中有关共价键的键能:
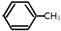 (g)+3H2(g)→ (g)+3H2(g)→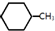 (g)的△H=-348kJ•mol-1 (g)的△H=-348kJ•mol-1 | |||||||||||
| C. | 一定量的复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,在某一时刻,反应的离子方程式可能是2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |||||||||||
| D. | 已知:25°C,Ksp(BaSO4)=1×10-10,向该温度下的饱和BaSO4溶液中加入一定量的硫酸钠或氯化钡固体后使Ksp(BaSO4)增大 |
分析 A、据电荷守恒分析;
B、苯环中不存在碳碳单键和碳碳双键;
C、据氢氧根离子首先和铁离子反应再和铵根离子反应分析;
D、Ksp只受温度影响.
解答 解:A、醋酸溶液中加入醋酸钠晶体,若混合液的pH=7,据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故A错误;
B、苯环中不存在碳碳单键和碳碳双键,据已知条件无法计算焓变,故B错误;
C、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,首先发生的反应离子方程式是2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓,故C正确;
D、Ksp只受温度影响,温度不变Ksp不变,故D错误;
故选:C.
点评 本题考查电荷守恒、焓变计算、溶液中的离子反应方程式书写、Ksp的影响因素,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热 46.3 kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
| A. | 达平衡时,两个容器中NH3的物质的量浓度相等 | |
| B. | 容器①中反应从开始到刚达平衡时用NH3表示的反应速率为v(NH3)=$\frac{1}{30}$mol•L-1•s-1 | |
| C. | 若容器①体积为0.3 L,则达平衡时放出的热量大于46.3kJ | |
| D. | 容器②中反应达到平衡时吸收的热量为Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滴定管装标准液时应先水洗后用标准液润洗再装入标准液 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 萃取实验中振荡分液漏斗时,应关闭其玻璃塞并打开活塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:
有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题: ;A单质及其最高价氧化物均属于原子晶体(填晶体类型)
;A单质及其最高价氧化物均属于原子晶体(填晶体类型)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应 | 离子方程式 | 评价 |
| A | NaClO溶液中通入过量SO2气体 | ClO-+H2O+SO2═HClO+HSO3- | 正确 |
| B | NH4HSO3溶液中加入等量NaOH | HSO3-+OH-═SO32-+H2O | 错误,OH-能同时与NH4+、HSO3-反应 |
| C | Na2CO3 的水解 | CO32-+H2O?CO2↑+2OH- | 错误,水解反应不加气体符号 |
| D | 用稀硝酸清洗做过银镜反应的试管 | Ag+4H++NO3-═Ag++NO↑+2H2O | 错误,等式两端电荷不守恒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | (NH4)2SO4 | NaHCO3 | Si | Fe2O3 |
| 用途 | 化肥 | 干燥剂 | 光电池 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com