
(15分)
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。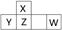
(1) 写出W的原子结构示意图: 。
(2) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3) 已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式:___________。
(6) 将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。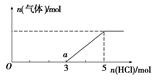
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
(1)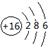 (2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-
(2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-
(3)CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1 (4)2SiO+ 2NaOH  Na2SiO3 + Si + H2O
Na2SiO3 + Si + H2O
(5)SO2 -2e-+ 2H2O = SO42-+ 4H+ (6)①Na2S、NaOH ②5 : 3
解析试题分析:根据题意可知这几种元素分别是:X是C;Y是Al;Z是Si;W是S。(1) S的原子结构示意图为 (2) 将足量CO2的最高价氧化物通入含AlO2-溶液中的反应的离子方程式为AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-.③-①-②×2整理可得CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1(4) ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+ 2NaOH
(2) 将足量CO2的最高价氧化物通入含AlO2-溶液中的反应的离子方程式为AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-.③-①-②×2整理可得CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1(4) ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+ 2NaOH  Na2SiO3 + Si + H2O(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。该反应的总方程式为2SO2+O2+2H2O=2H2SO4,,该电池负极反应式为SO2 -2e-+ 2H2O = SO42-+ 4H+ 。(6)①在NaOH的溶液中通入H2S,发生的反应:2NaOH+H2S=Na2S+2H2O.若二者恰好反应。则滴加HCl时应该是Na2S+HCl="NaCl+NaHS;" NaHS+HCl=NaCl+H2S↑.前后的盐酸消耗的体积相同。但是由于在开始产生气体时消耗HCl的体积为3,当气体达到最大值时体积为5,说明原固体中含有NaOH和Na2S。即O点溶液中所含溶质的化学式为NaOH和Na2S。②在O点溶液中所含溶质的化学式为NaOH和Na2S,当滴加HCl至完全反应时,根据元素守恒可得n(Na+)= n(Cl-)= 5;而在a至恰好反应还需要HCl的物质的量为2mol,因此在a点时溶液中的n(Cl-)=3.因此在a点溶液中,c(Na+): c(Cl-)= 5 : 3。
Na2SiO3 + Si + H2O(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。该反应的总方程式为2SO2+O2+2H2O=2H2SO4,,该电池负极反应式为SO2 -2e-+ 2H2O = SO42-+ 4H+ 。(6)①在NaOH的溶液中通入H2S,发生的反应:2NaOH+H2S=Na2S+2H2O.若二者恰好反应。则滴加HCl时应该是Na2S+HCl="NaCl+NaHS;" NaHS+HCl=NaCl+H2S↑.前后的盐酸消耗的体积相同。但是由于在开始产生气体时消耗HCl的体积为3,当气体达到最大值时体积为5,说明原固体中含有NaOH和Na2S。即O点溶液中所含溶质的化学式为NaOH和Na2S。②在O点溶液中所含溶质的化学式为NaOH和Na2S,当滴加HCl至完全反应时,根据元素守恒可得n(Na+)= n(Cl-)= 5;而在a至恰好反应还需要HCl的物质的量为2mol,因此在a点时溶液中的n(Cl-)=3.因此在a点溶液中,c(Na+): c(Cl-)= 5 : 3。
考点:考查元素的推断、原子结构示意图、离子方程式、热化学方程式的书写、原电池反应原理的应用及溶液中的成分的确定的知识。


科目:高中化学 来源: 题型:填空题
A、B、C、D是元素周期表前四周期常见的四种元素,原子序数依次增大, 它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
| 元素 | 相关结构和性质 |
| A | A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C | 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D | D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知元素A和B的原子序数都小于18,A元素原子的最外层电子数为a,次外层电子数为b,B元素M层电子数为 a-b,L层电子数为 a+b。请完成下列问题:
(1) 元素A在周期表中的位置
(2) 元素A的原子结构示意图
(3) 元素B的单质的一种用途
(4) 用B的氧化物的一种用途
(5) B元素的氧化物与NaOH溶液反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属 区元素,它的最外层电子的电子排布图为 。
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。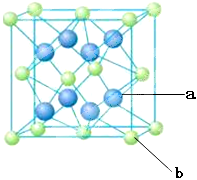
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式 。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为 。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为____________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是_________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,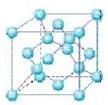 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
X、Y、Z、W是原子序数依次增大的四种短周期元素。X与W可形成四面体形的共价化合物,该化合物常用作灭火剂。Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数。
(1)用化学符号表示X的一种核素 。
(2)写出Y的单质与X的最高价氧化物反应的化学方程式 。
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子为 。
(4)用电子式表示Y与W形成化合物的过程为 。
(5)XW4的电子式为 。
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式。
①R作氧化剂: 。
②R作还原剂: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于σ键和π键的理解不正确的是( )
| A.σ键能单独形成,而π键一定不能单独形成 |
| B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C.HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D.气体单质中一定存在σ键,可能存在π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com