
| A. | 9mL | B. | 小于9mL | ||
| C. | 大于9 mL | D. | 因操作错误无法判断 |
分析 量筒放平稳后仰视液面读数,读出的体积数偏小,即实际体积大于19mL;倾倒部分液体后,又俯视液面,读出的体积比实际体积大,即实际体积小于10mL,据此判断
该学生实际倾倒的液体体积情况.
解答 解:某学生用量筒量取液体,量筒放平稳后仰视液面读得数值为19mL,仰视液面读数时读出的体积数偏小,即量筒中液态的实际体积大于19mL;
倾倒部分液体后,又俯视液面,读得数值为10mL,由于读出的体积比实际体积大,即实际体积小于10mL,则该学生实际倾倒液态的体积>19mL-10mL=9mL,
故选C.
点评 本题考查了常见仪器的构造及使用方法,题目难度不大,明确常见仪器的构造及使用方法即可解答,注意掌握俯视、仰视对读数的影响,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
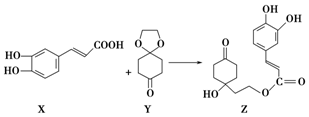
| A. | X的分子式为C9H8O4 | |
| B. | Y、Z中均含1个手性碳原子 | |
| C. | Z能发生加成反应、取代反应及消去反应 | |
| D. | 1 mol Z至多可与3 mol Br2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的主要成分是高级脂肪酸的甘油酯属于酯类 | |
| B. | 油脂易溶于水 | |
| C. | 天然油脂大多由混甘酯分子构成的混合物 | |
| D. | 脂肪里饱和烃基的相对含量较大,熔点 较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
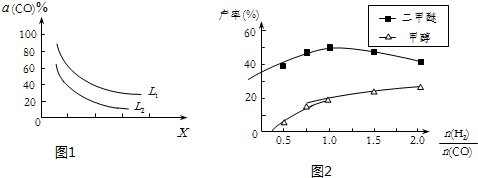
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com