
 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3为电解质,以丁烷(C4H10)为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为2C4H10+26CO${\;}_{3}^{2-}$-52e-═34CO2+10H2O.
熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3为电解质,以丁烷(C4H10)为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为2C4H10+26CO${\;}_{3}^{2-}$-52e-═34CO2+10H2O.分析 (1)丁烷和氧气反应生成二氧化碳和水;
(2)总反应式减去负极电极反应得到正极电极反应;
(3)正极上消耗二氧化碳,为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入CO2,二氧化碳也是负极产物;
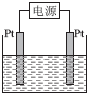
(4)①电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
②在水溶液里,氯气能将碘氧化生成盐酸和碘酸;
③根据氢氧化钠计算转移电子数,根据串联电池中转移电子数相等计算丁烷的体积.
解答 解:(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,
故答案为:2C4H10+13O2═8CO2+10H2O;
(2)总反应式减去负极电极反应得到正极电极反应,正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-═2CO32-或13O2+26CO2+52e-═26CO32-,
故答案为:O2+2CO2+4e-═2CO32-;
(3)由于通入空气的一极是电源的正极,正极上消耗二氧化碳,为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入CO2,该燃料电池负极电极反应式为2C4H10+26CO32--52e-═34CO2+10H2O,则二氧化碳在负极产生,
故答案为:CO2;负极反应产物;
(4)①电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
②阳极附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
③氢氧化钠物质的量=3.25mol/L×0.2L=0.65mol,根据2NaOH~2e-,生成0.65mol氢氧化钠时转移电子的物质的量为0.65mol,串联电池中转移电子数相等,
根据2C4H10~52e-,所以丁烷的体积为 $\frac{0.65mol×2}{52}$×22.4L/mol=0.56L=560mL,
故答案为:560.
点评 本题考查氧化还原反应及电解原理的应用,明确电解原理及离子的放电顺序、氧化还原反应的原理,结合元素的化合价变化即可解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 2.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 2.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 2.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳键键长:乙烯>苯 | B. | 沸点:正戊烷>异戊烷 | ||
| C. | 相对密度: > > | D. | 水溶性:CH3CH2OH>CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子在1s轨道上运动像地球围绕太阳旋转 | |
| B. | 2s的电子云半径比1s电子云半径大,说明2s能级的电子比1s的多 | |
| C. | 1s轨道的电子云形状为圆形的面 | |
| D. | nf能级中最多可容纳14个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.48L3717Cl2含有0.72NA个中子 | |
| B. | 3717Cl、3517Cl互为同位素,3717Cl2、3517Cl2互为同素异形体 | |
| C. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| D. | 3717Cl2的摩尔质量是74 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com