
| A. | Fe-3e一═Fe3+ | B. | Fe2+十20H-═Fe(OH)2 | ||
| C. | 2H20+02+4e-═40H- | D. | 4Fe(OH)2+2H20+02═4Fe(OH)3 |
分析 烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[Fe(OH)3失水的产物],是金属铁发生吸氧腐蚀的结果,正极发生的是氧气得电子的还原反应,负极是金属铁是失电子的氧化反应.
解答 解:A、金属铁发生吸氧腐蚀,负极是金属铁是失电子的氧化反应,即Fe-2e-═Fe2+,所以Fe-3e-=Fe3+不发生,故A正确;
B、正极发生的是氧气得电子的还原反应,即2H2O+O2+4e-═4OH-,负极是金属铁是失电子的氧化反应,即Fe-2e-═Fe2+,Fe2++2OH-═Fe(OH)2,合并得到:2Fe+2H2O+O2═2Fe(OH)2,故B错误;
C、金属铁发生吸氧腐蚀,正极发生的是氧气得电子的还原反应,即2H2O+O2+4e-═4OH-,故C错误;
D、氢氧化亚铁不稳定,易被氧气氧化为氢氧化铁,即4Fe(OH)2+O2+2H2O═4Fe(OH)3,故D错误;
故选:A.
点评 本题考查了金属吸氧腐蚀的原理,熟悉吸氧腐蚀的正负极反应是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2 NA? | |
| B. | 常温下,0.l mol碳酸钠晶体中含有CO32- 的个数为0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为8NA | |
| D. | 25℃时,l L pH=13的Ba(OH)2溶液中含有的OH- 数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的分子式都为(C6H10O5)n,所以淀粉和纤维素互为同分异构体 | |
| B. | 蛋白质水解生成葡萄糖并放出热量,提供生命活动的能量 | |
| C. | 糖类、油脂、蛋白质都属于天然高分子化合物 | |
| D. | 低级酯具有芳香气味,日常生活中的饮料、糖果盒糕点等常使用低级酯作香料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为-566 kJ/mol | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若投入1molCO2和3molH2在一定条件下充分反应,则放出热量49 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 单质硅是制光导纤维的材料 | |
| C. | 粗硅制备高纯度单质硅不涉及氧化还原反应 | |
| D. | 硅能与氢氟酸反应,则硅可以与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
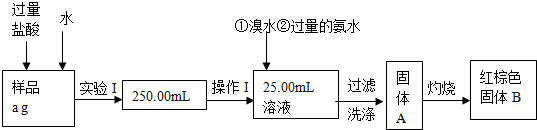

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液(CaCO3):加热 | B. | NaHCO3溶液(Na2CO3):加热 | ||
| C. | H2O(NaCl):蒸馏 | D. | 苯(水):萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com