
| A. | ②③④⑥⑦ | B. | ②③⑤⑦ | C. | ①③⑦ | D. | ①②③④⑥ |
分析 ①Zn和浓硫酸反应生成硫酸锌、二氧化硫,和稀硫酸反应生成硫酸锌和氢气;
②过量的氢气与少量的氮气在催化剂存在下充分反应,该反应存在可逆性;
③MnO2与浓盐酸在加热条件下反应生成氯气,和稀盐酸不反应;
④加热条件下,Cu和浓硫酸反应,和稀硫酸不反应;
⑤过量稀硝酸与铁反应生成硝酸铁和NO;
⑥过量的水与一定量的氯气反应生成HCl和HClO,该反应存在可逆性;
⑦常温下,Al和浓硫酸发生钝化现象.
解答 解:①Zn和浓硫酸反应生成硫酸锌、二氧化硫,和稀硫酸反应生成硫酸锌和氢气,所以过量的锌和浓硫酸反应时,浓硫酸能完全反应,故不选;
②过量的氢气与少量的氮气在催化剂存在下充分反应,该反应存在可逆性,所以一种物质过量,另一种物质仍不能完全反应,故选;
③MnO2与浓盐酸在加热条件下反应生成氯气,和稀盐酸不反应,所以一种物质过量,另一种物质仍不能完全反应,故选;
④加热条件下,Cu和浓硫酸反应,和稀硫酸不反应,所以一种物质过量,另一种物质仍不能完全反应,故选;
⑤过量稀硝酸与铁反应生成硝酸铁和NO,所以不存在稀硝酸过量,铁不完全反应现象,故不选;
⑥过量的水与一定量的氯气反应生成HCl和HClO,该反应存在可逆性,所以存在一种物质过量,另一种物质仍不能完全反应,故选;
⑦常温下,Al和浓硫酸发生钝化现象而导致铝、浓硫酸都不完全反应,所以存一种物质过量,另一种物质仍不能完全反应,故选;
故选A.
点评 本题考查物质之间反应,为高频考点,明确物质性质、反应条件是解本题关键,注意有些化学反应与反应物的量、反应物浓度、反应条件有关,题目难度不大.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO${\;}_{4}^{-}$+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH${\;}_{4}^{+}$+Al5++SO${\;}_{4}^{2-}$+Ba2++4OH-═BaSO4↓+Al(OH)5↓+NH5•H2O | |
| D. | 铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s时,用Z表示的反应速率为0.158 mol•(L•s)-1 | |
| B. | 反应开始到10s时,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应的化学方程式为X(g)+Y(g)?2Z(g) | |
| D. | 反应开始到10 s时,Y的转化率为39.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
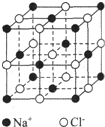
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
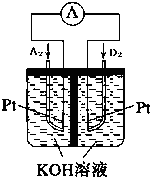 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
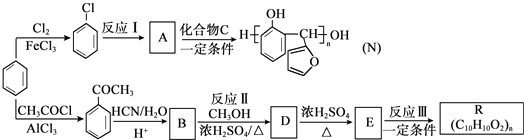

 .
. 生成
生成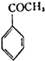 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂.
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
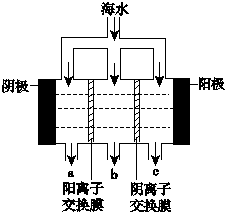 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na:两个钠元素 | |
| B. | 2OH-:两个氢氧根离子 | |
| C. | $\stackrel{+2}{M}$g:镁元素的化合价为+2价 | |
| D. | NO2:一个二氧化氮分子含有两个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
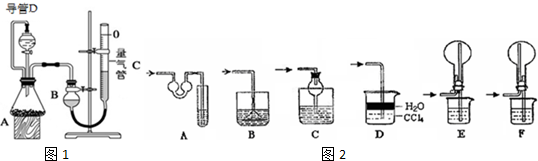
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com