
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)B+C(g) ΔH=+Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)反应∶n(C)生成=1∶1
C.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q kJ
D.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
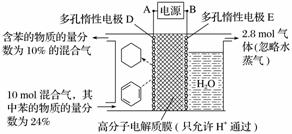
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.NaCl固体中含有共价键 B.CO2分子中含有离子键
C.12 6C、13 6C、14 6C是碳的三种核素 D.16 8O、17 8O、18 8O含有相同的中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是
A.元素X:它的原子中M层比L层少2个电子
B.元素Z:位于元素周期表中的第三周期第ⅢA 族
C.元素Y:它的二价阳离子核外电子总数与氩原子相同
D.元素W:它的焰色反应颜色呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出B、E两元素最高价氧化物的水化物反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)糖类、油脂、蛋白质能在人体中被__________(填“氧化”或“还原”),供给人体所需要的能量。根据溶解性的不同,维生素B类属于______________性维生素,维生素D属于________性维生素。
(2)下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品 名 | ××× |
| 配 料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
| 保质期 | 240天 |
| 生产日期 | 标于包装袋封口上 |
①富含蛋白质的是_________________________________________。
②富含糖类的是_______________________________________________。
③富含油脂的是______________________________________________。
④富含维生素的是________________________________________________。
(3)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠。其中属于调味剂的是__________________________________________,
属于防腐剂的是____________。
(4)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性 质 | 亚硝酸钠 | 氯化钠 |
| 酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 熔 点 | 271 ℃ | 801 ℃ |
| 室温时的溶解度 | 约80 g | 约35 g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:___________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com