
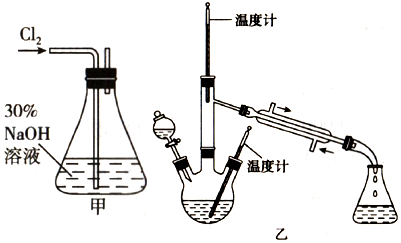
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):分析 实验一:制备NaClO溶液(1)氯气通入到盛有NaOH的锥形瓶中与NaOH发生反应生成氯化钠、次氯酸钠和水;
实验二:制取水合肼(2)依据制取水合肼(N2H4•H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,结合反应产物和反应物分析判断,水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化;
实验三:测定馏分中肼含量(3)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,是因为生成的HI与NaHCO3反应生成二氧化碳;
(5)结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数.
解答 解:实验一:制备NaClO溶液(1)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应为Cl2+2NaOH=NaCl+NaClO+H2O,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
实验二:制取水合肼(2)依据制取水合肼(N2H4•H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,结合反应产物和反应物分析判断,分液漏斗中的溶液是NaOH和NaClO混合溶液;水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化,
故答案为:D;如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
实验三:测定馏分中肼含量
(3)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,配制250mLNaHCO3溶液,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,还需要的仪器为胶头滴管,故还需要的仪器有:250mL容量瓶、胶头滴管,
故答案为:250mol容量瓶,胶头滴管;
(4)滴定过程中,N2H4•H2O+2I2═N2↑+4HI+H2O,NaHCO3能控制溶液的pH在6.5左右,是因为生成的HI与NaHCO3反应,生成碘化钠和水、二氧化碳,反应的离子方程式为:HCO3-+H+=C02↑+H2O;
故答案为:HCO3-+H+=C02↑+H2O;
(5)结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数,
N2H2•H2O+2I2=N2+4HI+H2O
1 2
n 0.1000mol/L×0.02L
n=0.001mol
250ml溶液中含有的物质的量=0.001mol×$\frac{250}{25}$=0.01mol
水合肼(N2H2•H2O)的质量分数=$\frac{0.01mol×50g/mol}{5.000g}$×100%=10%,
故答案为:10%.
点评 本题考查了物质制备和性质的实验分析和验证方法应用,主要是过程分析判断,侧重考查了实验操作、滴定的计算,提取题干信息并结合相关反应原理是解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 号序 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4 | CuSO4 | 加入足量铁粉后过滤 |
| ③ | O2 | CO2 | 依次通过盛有浓硫酸和NaOH溶液的洗气瓶 |
| ④ | CaO | CaCO3 | 加入稀盐酸,再蒸发 |
| A. | ①④ | B. | ② | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液、NaOH溶液、碱石灰 | B. | 浓氨水、NaOH固体、浓硫酸 | ||
| C. | NH4Cl固体、消石灰、碱石灰 | D. | 浓NaOH溶液、NH4C固体、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氯水再滴加KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ | |
| B. | 取某溶液进行焰色反应,透过蓝色钻玻璃焰色为紫色,则原溶液的溶质一定是KNO3 | |
| C. | 向某溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液不一定含有SO42- | |
| D. | 往Na2CO3和NaHCO3溶液中滴加酚酞都变红,说明Na2CO3和NaHCO3都是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
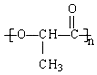 一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )
一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的聚合方式与聚苯乙烯相似 | ||
| C. | 聚乳酸的单体为CH3CH(OH)COOH | D. | 聚乳酸的链节为n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com