
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓度;
(2)依据配制溶液体积选择合适规格的容量瓶,依据溶液稀释过程 中溶质的物质的量不变计算需要浓盐酸的体积;
(3)依据配制一定物质的量浓度溶液的一般步骤解答;
A.依据洗涤的正确操作解答;
E.依据定容的操作解答;
(4)分析操作对溶质的物质的量、溶液体积的影响,根据c=$\frac{n}{V}$分析操作对所配溶液浓度的影响;
(5)实验过程中出现错误要重新配置.
解答 解:(1)浓盐酸的物质的量浓度为$\frac{1000×1.25×36.5%}{36.5}$=12.5mol/L,
故答案为:12.5mol.l-1;
(2)配制240mL0.1mol•L-1的盐酸,应选择250mL容量瓶,实际配制250mL溶液,设需要浓盐酸体积为V,则依据溶液稀释过程 中溶质的物质的量不变得:V×12.5mol/L=0.1mol/L×250mL,解得V=2.0mL;
故答案为:2.0;250;
(3)配制一定物质的量浓度的溶液步骤:计算、称量、溶解、转移、洗涤、定容、摇匀等,故正确的顺序为:BCAFED;
故答案为:BCAFED;
(4)①用以稀释浓硫酸的烧杯未洗涤,导致溶质偏少,浓度偏低;
故答案为:偏低;
②容量瓶中原有少量蒸馏水,对溶液的浓度无影响,溶液的浓度不变;
故答案为:不变;
③定容时观察液面俯视,导致溶液的体积偏小,溶液的浓度偏高;
故答案为:偏高;
(5)①定容时加蒸馏水时超过了刻度,溶液的浓度偏小,需要重新配置;故答案为:重新配置;
②向容量瓶中转移溶液时有滚液不慎有溶液溅出,溶液的浓度偏小,需要重新配置;故答案为:重新配置;
③定容摇勻后发现液面下降,溶液的浓度不变;故答案为:无需再配.
点评 本题考查了一定物质的量浓度溶液的配制以及误差分析,注意实验的基本操作方法和注意事项,属于基础型题目,难度不大.


科目:高中化学 来源: 题型:解答题
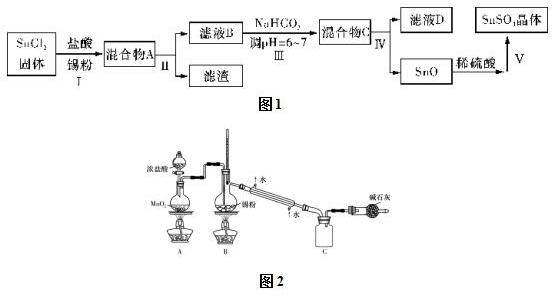
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 日常生活中无水乙醇常用于杀菌消毒 | |
| C. | SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色 | |
| D. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
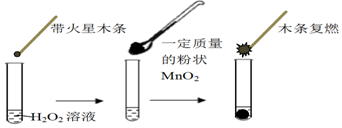
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 加入催化剂,有利于合成氨的反应 | |
| C. | 将混合气体中的氨液化,有利于合成氨的反应 | |
| D. | 工业生产硫酸的过程中,使用过量的空气以提高二氧化硫的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象 |
| 步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
| 步骤二:检验Fe3+,往试管Ⅰ中,滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 步骤三:检验Fe2+,往试管Ⅱ中,滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com