
分析 A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则A为O元素;B和C的原子序数之和是A的原子序数的3倍,B、C原子序数之和为24,B和C形成的离子具有相同的电子层结构,则B为Na、C为Al,据此进行解答.
解答 解:A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则A为O元素;B和C的原子序数之和是A的原子序数的3倍,B、C原子序数之和为24,B和C形成的离子具有相同的电子层结构,泽尔B为Na、C为Al,
(1)A为O元素,原子序数为8,位于周期表中第二周期、ⅥA族;由A和B形成的原子个数为1:1的化合物为Na2O2,阴阳离子数目之比为1:2,
故答案为:第二周期VIA族;1:2;
(2)B和C元素最高价氧化物的水化物分别为NaOH、Al (OH)3,二者反应的离子方程式为:OH-+Al (OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,推断元素为解题关键,侧重化学用语与元素化合物知识的考查,明确原子结构与元素周期律、元素周期表的关系,试题有利于培养学生的分析能力及灵活应用能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
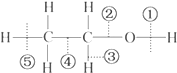
| A. | 乙醇和钠反应,键①断裂 | B. | 在铜催化下和O2反应,键①③断裂 | ||
| C. | 乙醇完全燃烧时键①②断裂 | D. | 与乙酸发生反应时,键①断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体属于原子晶体,其化学键比金刚石中的更牢固 | |
| B. | 该晶体中碳原子和氮原子的最外层都满足8电子结构 | |
| C. | 该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子 | |
| D. | 该晶体与金刚石相似,都是原子间以非极性共价键形成空间网状结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40℃时同浓度的H2O2的分解速率一定比10℃时分解速率快 | |
| B. | 实验室用氯酸钾制氧气,增大压强可使反应速率加快 | |
| C. | 改变固体表面积对化学反应速率没有影响 | |
| D. | 在可逆反应中,因受反应限度的影响,研究改变外界条件来提高产率是没有意义的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双键、三键中一定含有π键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 因每个原子未成对电子数是一定的,故配对原子个数也一定 | |
| D. | 每一个原子轨道在空间都具有方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与C2H4 | B. | CO与C2H4 | C. | CO 与C3H6 | D. | H2与C4H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com