
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.1mol·L1 CH3COOH溶液中加入0.1mol CH3COONa固体,平衡后则溶液中![]() _______(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:_______________
_______(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:_______________
(2)常温下向20mL 0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
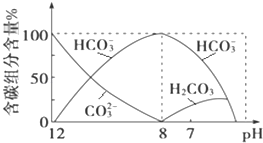
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有__________、________,溶液中含量最多的三种微粒的物质的量浓度的大小关系为_________;
③已知在25℃时,CO32-水解反应的平衡常数Kh═2×104mol·L1,当溶液中c(HCO3-):c(CO32-)=2∶1时,溶液的pH=_____。
【答案】不变 c(CH3COO)+c(OH)=c(Na+)+c(H+) 不能 HCO H2CO3 c(Na+)>c(Cl)>c(HCO) 10
【解析】
(1)根据平衡常数表达式及溶液中电荷守恒原理分析解答;
(2)根据碳酸钠与盐酸的分步反应及图像中离子浓度大小分析解答;根据水解平衡常数及水的离子积计算溶液的pH。
(1)![]() 表示醋酸的电离平衡常数,只和温度有关,所以加入CH3COONa固体时保持不变,此时溶液中存在电荷守恒:c(CH3COO)+c(OH)=c(Na+)+c(H+),故答案为:不变;c(CH3COO)+c(OH)=c(Na+)+c(H+);
表示醋酸的电离平衡常数,只和温度有关,所以加入CH3COONa固体时保持不变,此时溶液中存在电荷守恒:c(CH3COO)+c(OH)=c(Na+)+c(H+),故答案为:不变;c(CH3COO)+c(OH)=c(Na+)+c(H+);
(2)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中,H2CO3、HCO3、CO32不能大量共存,故答案为:不能;
②由图象可知,pH=7时,c(OH)=c(H+),溶液中含碳元素的主要微粒为HCO3、H2CO3,由电荷守恒可知c(Na+)+c(H+)=c(Cl)+c(HCO3)+c(OH),则c(Na+)>c(Cl),因HCO3水解,则c(Na+)>c(Cl)>c(HCO3),故答案为:HCO3、H2CO3;c(Na+)>c(Cl)>c(HCO3);
③CO32-的水解常数![]() ,当溶液中c(HCO3-):c(CO32-)=2∶1时,c(OH)=104mol/L,由Kw可知,c(H+)=1010mol/L,所以pH=10,故答案为:10。
,当溶液中c(HCO3-):c(CO32-)=2∶1时,c(OH)=104mol/L,由Kw可知,c(H+)=1010mol/L,所以pH=10,故答案为:10。


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2、ZnC2、Al4C3、Mg2C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A. Mg2C3水解生成丙炔B. Al4C3水解生成丙炔
C. ZnC2水解生成乙烷D. Li2C2水解生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用乙醇和浓硫酸在170℃时制乙烯,化学反应原理为CH3CH2OH![]() CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):
CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):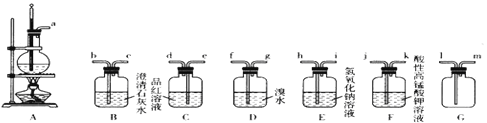
请回答下列问题:
(1)验证乙醇与浓硫酸混合反应产生了二氧化硫和二氧化碳。
①选择必要装置并进行连接:a→__________________(填接口序号)。
②确定混合气体中有二氧化碳存在的实验依据_________________________________。
(2)选择装置制备1,2—二溴乙烷。
①该同学设计的方案中装置连接顺序为A→E→D。此方案是否合理?_________(填“合理”或“不合理”);若不合理,请提出改进方案或方法____________________。
②分离出1,2—二溴乙烷的操作中使用的玻璃仪器为________________________。
③有同学建议在A、E之间增加G装置,其作用是_______,a与G装置接口_______(填“1”或“m”)连接。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜锌原电池中,盐桥中的K+和NO![]() 分别移向负极和正极
分别移向负极和正极
B. SiO2(s)+2C(s)===Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
C. 室温下,将Na2CO3和NaHCO3的混合溶液加水稀释,![]() 减小
减小
D. 电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于6.02×1022
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大压强颜色变深
H2(g)+I2(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN-
B.使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO![]()
C.能与Al反应放出大量H2的溶液中:NH![]() 、Na+、Cl-、HCO
、Na+、Cl-、HCO![]()
D.![]() =10-12的溶液中:Mg2+、Al3+、NO
=10-12的溶液中:Mg2+、Al3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究
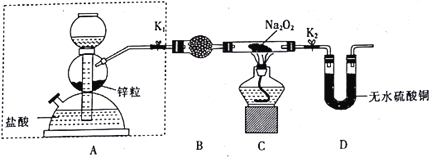
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:
![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.强酸性环境中K+、Na+、 Cl- 、HCO3- 不能大量共存:HCO3-+H+=CO2 +H2O
B.碳酸钠溶液显碱性:CO32-+2H2O ![]() H2CO3 +2OH-
H2CO3 +2OH-
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
D.将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com