
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
分析 A.先计算H2O和D2O的物质的量,再计算分子中质子数;
B.${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl是氯原子,核外电子数相同,最外层电子数相同,得到电子能力相同;
C.同位素是质子数相同的不同原子;
D.原子符号是质量数标注在左上角,质子数在左下角.
解答 解:A.质量相同的H2O和D2O的物质的量为:$\frac{18g}{18g/mol}$,$\frac{18g}{20g/mol}$,所以质子数$\frac{18g}{18g/mol}$×10,$\frac{18g}{20g/mol}$×10,质子数不同,故A错误;
B.${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl是氯原子,核外电子数相同,最外层电子数相同,得到电子能力相同,故B正确;
C.同位素是质子数相同的不同原子,第IA族元素铯的两种同位素137Cs比133Cs质子数相同,故C错误;
D.原子符号是质量数标注在左上角,质子数在左下角,中子数为146、质子数为92的铀(U)原子,质量数=146+92=238,原子符号23892U,故D错误;
故选B.
点评 本题考查了原子结构、微粒数计算分析,掌握微粒之间的计算方法和表示方法是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 提高CO2充气压力,饮料中c(A-)不变 | |
| B. | 当pH为5.0时,饮料中 $\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| C. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| D. | 结合H+的能力:A->HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
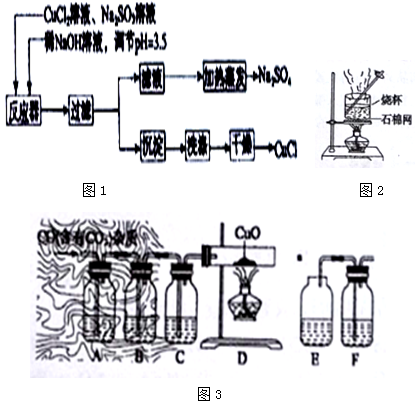
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与盐酸反应生成氢气 | B. | 氢氧化铝溶于强碱溶液 | ||
| C. | 氢氧化铝溶于强酸溶液 | D. | 铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
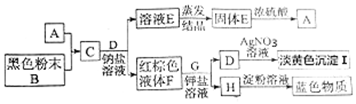
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③⑥ | C. | 只有② | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
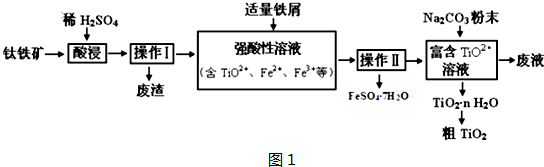
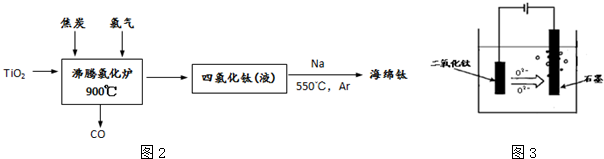
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
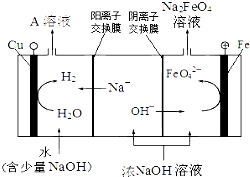
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
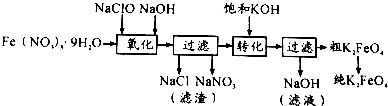
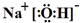 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com