
【题目】下列各反应中,水作还原剂的是( )
A.2H2+O2 ![]() 2H2O
2H2O
B.2F2+2H2O═4HF+O2
C.SO3+H2O═H2SO4
D.2Na+2H2O═2NaOH+H2↑
【答案】B
【解析】A.2H2+O2 ![]() 2H2O中,水为生成物,则水不是还原剂,A不符合题意;
2H2O中,水为生成物,则水不是还原剂,A不符合题意;
B.2F2+2H2O═4HF+O2中,水中O元素的化合价升高,则水作还原剂,B符合题意;
C.SO3+H2O═H2SO4中,各元素的化合价没有变化,则不属于氧化还原反应,水为反应物,C不符合题意;
D.2Na+2H2O═2NaOH+H2↑中,水中H元素的化合价降低,则水为氧化剂,D不符合题意;
故答案为:B.
氧化还原反应概念的判断。A.水为生成物,则水不是还原剂;B.水中O元素的化合价升高,则水作还原剂;C.各元素的化合价没有变化,则不属于氧化还原反应;D.水中H元素的化合价降低,则水为氧化剂。


科目:高中化学 来源: 题型:
【题目】分析下表中各项的排布规律,按此规律排布第30项应为( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
A. C8H18 B. C8H16O2 C. C9H20 D. C9H20O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图甲、乙两种化合物的结构或性质描述正确的是( ) 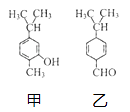
A.甲和乙互为同分异构体,均既能发生氧化反应,又能发生酯化反应
B.分子中共平面的碳原子数相同
C.可用红外光谱区分,但不能用核磁共振氢谱区分
D.均能与溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)31Ga基态原子的核外电子排布式是 , 某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是 , 其晶体结构类型可能为 .
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构式如图所示:以下关于维生素B1的说法正确的是 . 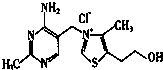
a.只含σ键和π键
b.既有共价键又有离子键
c.该物质的熔点可能高于NaCl
d.既含有极性键又含有非极性键
(3)维生素B1晶体溶于水的过程中要克服的微粒间的作用力有 .
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2 , 且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题: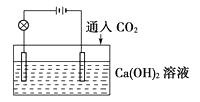
(1)通入CO2前,灯泡(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度。
(3)继续通入过量的CO2 , 灯泡的亮度。
(4)下列四个图中,(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。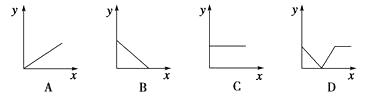
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中.氧化反应与还原反应在同一种元素中进行的是 ( )
A.Zn+H2SO4═ZnSO4+H2↑
B.2FeCl2+Cl2═2FeCl3
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.Cl2+H2O═HClO+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有下列四种溶液:
① | ② | ③ | ④ | |
溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1molL﹣1的醋酸 | 0.1molL﹣1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10﹣5 . 请回答下列问题:
(1)用④的标准液滴定③宜选用(填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 .
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是(用序号表示),用pH试纸测定溶液pH的操作方法是 .
(3)都是0.1mol/L的①NH4Cl、②NH4HCO3、③CH3COONH4、④NH4HSO4的溶液中NH4+离子浓度大小顺序为 . (用序号填写)
(4)取适量溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为 . 若b点时消耗③的体积为V mL,则V20(填“>”、“<”或“=”). 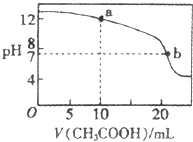
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: 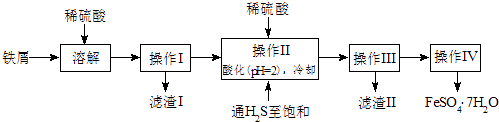
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)操作II中,通入硫化氢至饱和的目的是;在溶液中用硫酸酸化至pH=2的目的是 .
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质,② .
(3)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL. ①滴定时发生反应的离子方程式为: .
②滴定时盛放KMnO4溶液的仪器为(填仪器名称).判断此滴定实验达到终点的方法是
③计算上述样品中FeSO47H2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N的晶胞结构如图,N3﹣的配位数为 , Cu+半径为acm,N3﹣半径为bcm,Cu3N的密度为gcm﹣3 . ( 阿伏伽德罗常数用NA表示,Cu、N相对分子质量为64、14) 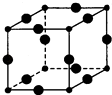
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com