
| A. | 玻璃、水晶和陶瓷都是传统硅酸盐材料 | |
| B. | 可溶性铝盐和铁盐可用作净水剂 | |
| C. | SO2和NO都能形成酸雨而破坏环境 | |
| D. | CO2和CH4都是引起温室效应的气体 |
分析 A.水晶主要成分是二氧化硅;
B.铝离子和铁离子属于弱根离子,能水解生成氢氧化铝和氢氧化铁胶体;
C.依据酸雨成因解答;
D.CO2、CH4和氮氧化合物都是形成温室效应的气体.
解答 解:A.水晶主要成分是二氧化硅,是氧化物不是硅酸盐,故A错误;
B.铝离子和铁离子属于弱根离子,能水解生成氢氧化铝和氢氧化铁胶体,胶体具有吸附性,能吸附悬浮物而净水,故B正确;
C.酸雨与二氧化硫、氮的氧化物排放有关,故C正确;
D.CO2、CH4和氮氧化合物都是形成温室效应的气体,故D正确;
故选:A.
点评 本题考查了元素化合物知识,涉及硅及其化合物、酸雨、温室效应的成因等,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| X | Y | ||||
| Z | W | Q |
| A. | Y与Z的简单离子的半径大小关系为Y2->Z2+ | |
| B. | Z单质可以在X和Y组成的化合物中燃烧 | |
| C. | W与Y组成的某种化合物是光导纤维的主要成分 | |
| D. | Q单质具有强氧化性和漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
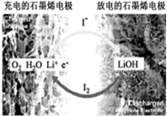 科学家开发出一种新型电池,其能量密度极高,效率达90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH,对于该电池的下列说法不正确的是( )
科学家开发出一种新型电池,其能量密度极高,效率达90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH,对于该电池的下列说法不正确的是( )| A. | 充电时Li+从阳极区移向阴极区 | |
| B. | 充电时阴极反应为LiOH+e-═Li+OH- | |
| C. | 放电时负极上I-被氧化 | |
| D. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在三氯化铁的酸性溶液中通入足量的硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ | |
| B. | PbS与CuSO4溶液反应PbS+Cu2+═CuS+Pb2+ | |
| C. | Mg(HCO3)2与过量澄清石灰水反应 Mg2++2HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O | |
| D. | 铜银合金在稀硫酸溶液中构成原电池,正极反应式 2H+2e═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ①②④⑧ | C. | ②③⑥⑧ | D. | ①②⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 现象或事实 | 解释 |
| A | 可用铁制容器储存、运输浓硫酸 | 常温下铁与浓硫酸不反应 |
| B | 可用二氧化硫漂白纸浆、草帽等 | 二氧化硫具有氧化性 |
| C | 可用碳酸钠溶液将水垢中的硫酸钙转化为碳酸钙 | Ksp(CaSO4)>Ksp(CaCO3) |
| D | 福尔马林常用来保存新鲜食品 | 福尔马林具有杀菌防腐性能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焊锡中加铅后熔点降低 | |
| B. | 用漂白粉、臭氧等游泳池消毒 | |
| C. | 将镁块与钢铁输水管相连,防止钢铁腐蚀 | |
| D. | 往燃煤中加入石灰石,减少酸雨的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
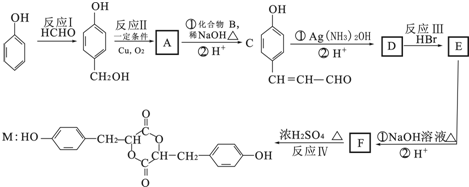
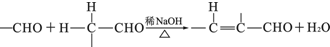
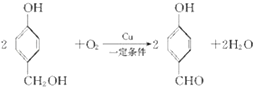 ;
;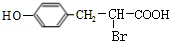 ;
;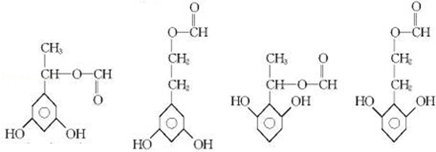 任意2种(任写两种).
任意2种(任写两种).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
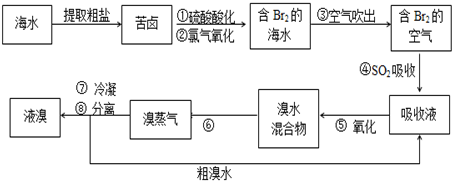
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com