
【题目】降低发动机中柴油燃烧产生NOx的排放,可利用尿素分解产生的气体采用选择性催化还原技术或储存还原技术来消除污染。
(1)选择性催化还原技术工作原理为:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式_________。
②用2Kg尿素能处理标准状况下含NOx(以NO2计)体积分数为7%的尾气10m3,则该尿素的利用率为_____________。
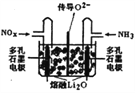
③将上述尾气处理原理设计成原电池,在处理了废气的同时产生电能,其工作原理如图所示。则通入NH3的一极为_______________极,通入NOx时发生的电极反应方程式为___________。
(2)储存还原技术工作原理为:NOx的储存和还原在不同时段交替进行,如图所示。
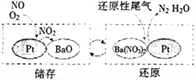
①写出上图中储存NO时发生的反应总方程式________________________。
②还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是(15N2N)2O3。将该反应的化学方程式补充完整:________![]() 口(15N2N)2O3+口H2O
口(15N2N)2O3+口H2O
【答案】 H2O+CO(NH2)2![]() 2NH3↑+CO2↑ 0.625 负 2NOx +4xe-= N2 +2xO2- 4NO+3O2+2BaO=2Ba(NO3)2 415NO+2NH3+O2
2NH3↑+CO2↑ 0.625 负 2NOx +4xe-= N2 +2xO2- 4NO+3O2+2BaO=2Ba(NO3)2 415NO+2NH3+O2![]() (15N2N)2O3+3H2O
(15N2N)2O3+3H2O
【解析】试题分析:本题以消除NOx的污染为载体,考查化学方程式的书写,化学计算,原电池的工作原理和电极反应式的书写。
(1)①尿素水溶液受热分解生成NH3和CO2,反应的化学方程式为H2O+CO(NH2)2![]() 2NH3↑+CO2↑。
2NH3↑+CO2↑。
②依据题意,尿素热分解产生的NH3将NO2还原为N2消除污染,NH3被氧化成N2,根据得失电子守恒,3n(NH3)=4n(NO2),n(NH3)=![]() n(NO2)=
n(NO2)=![]() =
=![]() mol,则消耗的CO(NH2)2物质的量为
mol,则消耗的CO(NH2)2物质的量为![]() mol,尿素的利用率为
mol,尿素的利用率为![]() mol
mol![]() =0.625。
=0.625。
③该处理过程中NH3发生氧化反应生成N2,通入NH3的一极为原电池的负极。通入NOx的一极为正极,NOx发生还原反应生成N2,N元素的化合价由+2x价降至0价,结合电解质为熔融Li2O,通入NOx的电极的电极反应式为2NOx+4xe-=N2+2xO2-。
(2)①由图可见储存时的反应为:2NO+O2=2NO2、4NO2+O2+2BaO=2Ba(NO3)2,将两式相加消去NO2,得反应的总方程式为4NO+3O2+2BaO=2Ba(NO3)2。
②根据(15N2N)2O3中15N与N物质的量之比为2:1,则15NO与NH3物质的量之比为2:1,15NO得到电子物质的量与NH3失去电子物质的量之比为(2![]() 1):(1
1):(1![]() 4)=1:2,根据得失电子守恒,参与反应的15NO、NH3、O2物质的量之比为4:2:1,结合原子守恒,写出方程式为415NO+2NH3+O2
4)=1:2,根据得失电子守恒,参与反应的15NO、NH3、O2物质的量之比为4:2:1,结合原子守恒,写出方程式为415NO+2NH3+O2![]() (15N2N)2O3+3H2O。
(15N2N)2O3+3H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据下图转化关系以及实验现象填写下列空白。
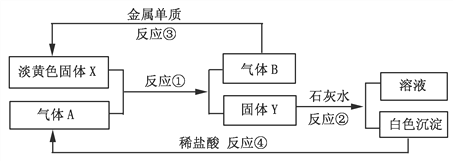
(1)气体A是___________,图中溶液的溶质是____________(填写化学式);
(2)反应①的化学方程式是______________________;
(3)反应④的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.02mmol/LNaOH溶液滴定0.01mol/L的H2SO4溶液,中和后加水到100mL.若滴定时终点判断有误差:①多加了一滴NaOH,②少加了一滴NaOH(设1滴为0.05mL),则①和②溶液中c(OH﹣)比值是( )
A.1
B.104
C.104
D.4×104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含少量Na2CrO4,考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。已知:阴极池中得到NaOH和H2,阳极池中得到含有Cr2O72-和CrO42-的混合溶液。

(1)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是____________________。
(2)离子交换膜I属于________________(填“阳膜”或“阴膜”),阳极的电极反应方程式为___。生成Cr2O72-的原因____________(离子反应方程式和必要的文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cl2制成漂白粉的最主要目的是:①使它转变成较易溶于水的物质 ②转变成较稳定、便于贮存的物质 ③提高氯的质量分数 ④提高漂白能力
A.①②③B.②④C.②③D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg ![]() MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在马铃薯幼苗的培养液中,除了必需的微量元素、NH+4、PO43-和CO2外,还必需的大量元素是( )
A.C、H、O、N、P、MnB.K、Ca、Mg、S
C.Mn、Mo、Cu、ZnD.K、Ca、Mg、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将23gNa、18gAl、56gFe分别投入盛有200g 7.3%的盐酸中(气体体积均在相同状况下测定),下列分析正确的是( )
A. 产生的气体体积之比为5:2:2
B. Al和盐酸的反应速率仅次于钠,但产生的气体最多
C. 铁和盐酸反应产生的气体比Na产生的多
D. Na和盐酸反应最剧烈,反应结束时产生的气体一样多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com