
| A、CH3COOH |
| B、Cl2 |
| C、NH4HCO3 |
| D、SO3 |


科目:高中化学 来源: 题型:
| A、H+ Ca2+ Cl- CO32- |
| B、Na+ Mg2+ SO42- OH- |
| C、K+ Na+ OH- Cl- |
| D、Cu2+Ba2+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化物形成的晶体为分子晶体 |
| B、最高价氧化物对应的水化物是一种强酸 |
| C、其单质既有氧化性又有还原性 |
| D、是植物生长所需要的一种营养元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶于水后,在电流作用下电离成Na+和Cl- |
| B、在水溶液里,能电离出H+的化合物叫酸 |
| C、碳酸钙难溶于水,但碳酸钙是强电解质 |
| D、氯气溶于水后,能部分电离出H+和Cl-,故氯气属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述混合液B分置于试管1、试管2中. | |
| 步骤2 | 往试管1中滴加 | |
| 步骤3 | 往试管2中滴加 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
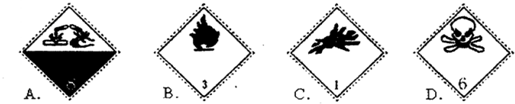
| A、图中所示标志是腐蚀品标志 |
| B、图中所示标志是易燃品标志 |
| C、图中所示标志是爆炸品标志 |
| D、图中所示标志是剧毒品标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ | Na+ | Cu2+ | Al3+ |
| 阴离子 | SO42- | HCO3- | NO3- | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com