
【题目】(1)在配制Na2S溶液时,为了抑制水解,可以加入少量的________(填化学式);其水解的离子方程式为____________。
(2)0.1 mol/L的NaHCO3溶液的pH为8,同浓度的AlCl3溶液的pH为4。将两种溶液等体积混合,可能发生的现象是____________________________其主要原因是(用离子方程式表示) ______________________________。
(3)明矾常作净水剂,其净水原理用离子方程式可表示为____________________________。
【答案】NaOH溶液 S2-+H2O![]() HS-+OH- 产生白色沉淀,有气泡产生 Al3++3HCO3- ===Al(OH)3↓+3CO2 Al3++3H2O
HS-+OH- 产生白色沉淀,有气泡产生 Al3++3HCO3- ===Al(OH)3↓+3CO2 Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
【解析】
(1)Na2S属于强碱弱酸盐,水解显碱性,加碱抑制其水解;
(2)NaHCO3水解过程大于电离过程,溶液显碱性,氯化铝溶液水解显酸性,二者混合相互促进水解;
(3) 铝离子水解生成氢氧化铝胶体,具有吸附作用;
(1)Na2S属于强碱弱酸盐,水解显碱性,离子方程式为:S2-+H2O![]() HS-+OH- ,为了抑制水解,可以加入少量的NaOH溶液,增大OH-浓度,平衡左移;
HS-+OH- ,为了抑制水解,可以加入少量的NaOH溶液,增大OH-浓度,平衡左移;
综上所述,本题答案是:NaOH溶液;S2-+H2O![]() HS-+OH- 。
HS-+OH- 。
(2)NaHCO3是碳酸的酸式盐,既有电离的趋势,又有水解趋势,0.1 mol/L的NaHCO3溶液的pH为8,说明水解大于电离,显碱性;AlCl3属于强酸弱碱盐,水解显酸性,溶液的pH为4,将两种溶液等体积混合,会相互促进水解,产生白色沉淀,同时有气泡产生;离子方程式为:Al3++3HCO3- ===Al(OH)3↓+3CO2;
综上所述,本题答案是:产生白色沉淀,有气泡产生; Al3++3HCO3- ===Al(OH)3↓+3CO2。
(3) 明矾中含有铝离子,能够发生水解生成氢氧化铝胶体,具有吸附作用,能够做净水剂,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
综上所述。本题答案是:Al3++3H2O![]() Al(OH)3+3H+。
Al(OH)3+3H+。


科目:高中化学 来源: 题型:
【题目】已知在常温下测得浓度均为0.1molL﹣1的下列四种溶液的pH如下表:
溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
pH | 8.4 | 11.6 | 7.5 | 9.7 |
(1)用离子方程式表示NaClO溶液的pH = 9.7的原因___________________________。
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的由大到小顺序为_________________________________ (填序号)。
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:________________。
(4)常温下,将CO2通入0.1molL﹣1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+ c(HCO3-)=_________________(列计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
②下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为1.12 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中盛有1 mol PCl5,加热到200℃时发生了反应:PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
A. M>N B. M<N C. M=N D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Li和石墨的复合材料以及纳米Fe2O3材料作电极的锂离子电池,在循环充放电过程中可实现对磁性的可逆调控(如图)。下列有关说法一定错误的是
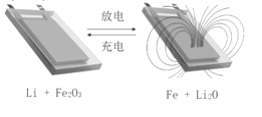
A. 该电池的电解质溶液可以是硫酸溶液
B. 放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe
C. 充电时,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+
D. 充放电过程中,电池可在被磁铁不吸引和吸引之间循环调控
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 根据图①可判断该可逆反应正反应为吸热反应
B. 若②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,则乙对应的压强大
3C(g)+D(s)的影响,则乙对应的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶被中的Fe3+,可向溶液中加入适量CuO,调节pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com